Tổng hệ số cân bằng của phản ứng là: Mg + HNO3 → Mg(NO3)2+ N2O + H2O
(1 Point)
77
24
58
29
Cho phản ứng sau : Mg + HNO3 → Mg(NO3)2 + NO + N2O + H2O (tỉ lệ số mol giữa NO và N2O là 2 : 1). Hệ số cân bằng tối giản của HNO3 trong phương trình hoá học là
A. 18
B. 20
C. 12
D. 30
Chọn A
Theo bảo toàn electron và bảo toàn nguyên tố Mg, ta có
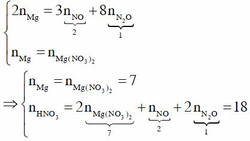
Cho phản ứng sau: Mg + HNO3 ® Mg(NO3)2 + NO + N2O + H2O
Nếu tỉ lệ số mol giữa NO và N2O là 2:1, thì hệ số cân bằng tối giản của trong phương trình hóa học là:
A. 20
B. 12
C. 18
D. 30
Cân bằng các phương trình phản ứng sau:
a. Mg + HNO3 → Mg(NO3)2 + NO + H2O.
b. Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O.
c. Mg + H2SO4 → MgSO4 + H2S + H2O.
d. Al + HNO3 → Al(NO3)3 + N2O + H2O.
a) 3Mg + 8HNO3 --> 3Mg(NO3)2 + 2NO + 4H2O
b) 2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
c) 8Mg + 10H2SO4 --> 8MgSO4 + 2H2S + 8H2O
d) 8Al + 30HNO3 --> 8Al(NO3)3 + 3N2O + 15H2O
Cho sơ đồ phản ứng : Al + HNO3 -> Al(NO3)3 + N2 + N2O + H2O
A l + H N O 3 → A l H N O 3 3 + N 2 + N 2 O + H 2 O
Hệ số của HNO3 sau khi cân bằng là:
A. 213
B. 126
C. 162
D. 132
Đáp án C.
Ta có: tỉ lệ số mol giữa N2O và N2 là 3: 2
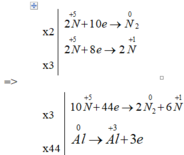
Pt sau cân bằng: 44Al + 162HNO3 ® 44Al(NO3)3 + 6N2 + 9N2O + 81H2O.
Cho phản ứng oxi hóa sau: Fe(OH)2 + HNO3 → Fe(NO3)3 + N2O + H2O. Hệ số cân bằng của H2O trong phản ứng trên là: (Biết hệ số cân bằng là những số nguyên, tối giản)
A. 13.
B. 18.
C. 26.
D. 21.
Cho phản ứng oxi hóa sau: Fe(OH)2 + HNO3 → Fe(NO3)3 + N2O + H2O. Hệ số cân bằng của H2O trong phản ứng trên là: (Biết hệ số cân bằng là những số nguyên, tối giản)
A. 13
B. 18
C. 26.
D. 21
Cho phản ứng oxi hóa sau: Fe(OH)2 + HNO3 → Fe(NO3)3 + N2O + H2O. Hệ số cân bằng của H2O trong phản ứng trên là: (Biết hệ số cân bằng là những số nguyên, tối giản)
A. 13.
B. 18.
C. 26.
D. 21.
Cho phản ứng:
M g + H + + H N O 3 - → M g 2 + + N 2 + H 2 O
Sau khi cân bằng, tổng hệ số cân bằng của các chất trong phản ứng là
A. 32
B. 30.
C. 28.
D. 31.
Cho phản ứng oxi hóa – khử: Al + HNO3 ® Al(NO3)3 + N2O + N2 + H2O
Cho tỉ lệ mol n N 2 O : n N 2 = 1 : 2 . Hệ số cân bằng của HNO3 là
A. 22
B. 96
C. 102
D. 60