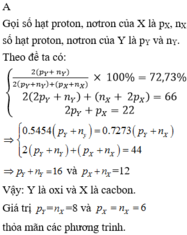Cho hợp chất XY2 có tổng số electron trong phân tử là 54; trong đó số electron của cation X2+ ít hơn số electron của anion Y- là 18. Vị trí của X và Y trong Bảng tuần hoàn các nguyên tố hóa học là

Những câu hỏi liên quan
Hợp chất XY2 phổ biến trong sử dụng để làm cơ chế đánh lửa bằng bánh xe trong các dạng súng cổ. Mỗi phân tử XY2 có tổng số hạt proton, electron và neutron bằng 178. Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 54, số hạt mang điện của X ít hơn só hạt mang điện của Y là 12. Hãy xác định kí hiệu hóa học của X, Y
Ta có: P = E (Do nguyên tử trung hòa về điện.)
- Mỗi phân tử XY2 có tổng số hạt p, n, e là 178.
⇒ 2PX + NX + 2.2PY + 2NY = 178 (1)
- Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 54.
⇒ 2PX + 2.2PY - NX - 2NY = 54 ⇒ NX + 2NY = 2PX + 2.2PY - 54 (2)
Thay (2) vào (1) ⇒ 4PX + 8PY = 232 (*)
- Số hạt mang điện của X lớn hơn số hạt mang điện của Y là 12.
⇒ 4PY - 2PX = 12 (**)
Từ (*) và (**) \(\Rightarrow\left\{{}\begin{matrix}P_X=26=Z_X\\P_Y=16=Z_Y\end{matrix}\right.\)
→ KHHH của X và Y lần lượt là Fe và S.
Đúng 1
Bình luận (0)
Một hợp chất có công thức
X
Y
2
trong đó Y chiếm 50% về khối lượng. Trong hạt nhân của X có n p và hạt nhân Y có n’ p’. Tổng số proton trong phân tử
X
Y
2
là 32. Cấu hình electron của X và Y và liên kết trong phân tử
X
Y
2
là A.
3
s
2
3
p...
Đọc tiếp
Một hợp chất có công thức X Y 2 trong đó Y chiếm 50% về khối lượng. Trong hạt nhân của X có n = p và hạt nhân Y có n’ = p’. Tổng số proton trong phân tử X Y 2 là 32. Cấu hình electron của X và Y và liên kết trong phân tử X Y 2 là
A. 3 s 2 3 p 4 , 2 s 2 2 p 4 và liên kết cộng hóa trị
B. 3 s 2 , 2 s 2 2 p 5 và liên kết ion
C. 3 s 2 3 p 5 , 4 s 2 và liên kết ion
D. 3 s 2 3 p 3 , 2 s 2 2 p 3 và liên kết cộng hóa trị
Chọn A
Y chiếm 50% về khối lượng → MX = 2MY → nX + pX = 2 nY + 2 pY (1)
nX = pX; nY = pY (2)
pX + 2pY = 32 (3)
→ pX = 16 (S): [Ne]3s23p4; pY = 8 (O): [He]2s22p4
Liên kết trong phân tử SO2 là liên kết cộng hóa trị.
Đúng 1
Bình luận (0)
Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số nơtron. Tổng số proton trong phân tử XY2 là 32. Cấu hình electron phù hợp với X và Y là: A. X : 1s22s22p63s23p4, Y: 1s22s22p4 B. X : 1s22s22p63s2, Y: 1s22s22p4 C. X : 1s22s22p63s23p4, Y: 1s22s22p2 D. X : 1s22s22p63s23p2, Y: 1s22s22p6
Đọc tiếp
Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số nơtron. Tổng số proton trong phân tử XY2 là 32. Cấu hình electron phù hợp với X và Y là:
A. X : 1s22s22p63s23p4, Y: 1s22s22p4
B. X : 1s22s22p63s2, Y: 1s22s22p4
C. X : 1s22s22p63s23p4, Y: 1s22s22p2
D. X : 1s22s22p63s23p2, Y: 1s22s22p6
Đáp án A.
Gọi số hạt proton, nơtron, electron của nguyên tử X là p, n, e và của Y là p’, n’, e’.
Theo bài : p = n = e và p’ = n’ = e’.
Trong hợp chất XY2, X chiếm 50% về khối lượng nên:
![]()
Tổng số proton trong phân tử XY2 là 32 nên p + 2p’ = 32.
Từ đây tìm được: p = 16 (S) và p’ = 8 (O). Hợp chất cần tìm là SO2.
Cấu hình electron của S: 1s22s22p63s23p4 và của O: 1s22s22p4.
Đúng 0
Bình luận (0)
Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số nơtron. Tổng số proton trong phân tử XY2 là 32. Viết cấu hình electron của X. A. 1s22s22p63s23p4 B. 1s22s22p4 C. 1s22s22p63s2 D.1s22s22p63s23p2
Đọc tiếp
Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số nơtron. Tổng số proton trong phân tử XY2 là 32. Viết cấu hình electron của X.
A. 1s22s22p63s23p4
B. 1s22s22p4
C. 1s22s22p63s2
D.1s22s22p63s23p2
Đáp án A.
Gọi số hạt proton, nơtron, electron của nguyên tử X là p, n, e và của Y là p’, n’, e’.
Theo bài : p = n = e và p’ = n’ = e’.
Trong hợp chất XY2, X chiếm 50% về khối lượng nên:
M X 2 M Y = 50 50 ⇒ p + n 2 ( p ' + n ' ) = 1 ⇒ p = 2 p '
Tổng số proton trong phân tử XY2 là 32 nên p + 2p’ = 32.
Từ đây tìm được: p = 16 (S) và p’ = 8 (O). Hợp chất cần tìm là SO2.
Cấu hình electron của S: 1s22s22p63s23p4
Đúng 0
Bình luận (0)
Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số nơtron. Tổng số proton trong phân tử XY2 là 32.Cấu hình electron của X và Y A. X: 1s22s22p63s23p4 và Y: 1s22s22p4 B. X: 1s22s22p63s23p3 và Y: 1s22s22p4 C. X: 1s22s22p63s23p6 và Y: 1s22s22p4 D. X: 1s22s22p63s23p4 và Y: 1s22s22p6
Đọc tiếp
Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số nơtron. Tổng số proton trong phân tử XY2 là 32.Cấu hình electron của X và Y
A. X: 1s22s22p63s23p4 và Y: 1s22s22p4
B. X: 1s22s22p63s23p3 và Y: 1s22s22p4
C. X: 1s22s22p63s23p6 và Y: 1s22s22p4
D. X: 1s22s22p63s23p4 và Y: 1s22s22p6
Đáp án A
Gọi số hạt prroton, nơtron, electron của nguyên tử X là P, N, E và của Y là P’, N’, E’
Theo bài: P = N = E và P’ = N’ = E’
Trong hợp chất XY2, X chiếm 50% về khối lượng nên: ![]() = 1 « P = 2P’
= 1 « P = 2P’
Tổng số proton trong phân tử XY2 là 32 nên P + 2P’ = 32
Từ đây tìm được: P = 16 (S) và P’ = 8 (O)
Hợp chất cần tìm là SO2
Cấu hình electron của S: 1s22s22p63s23p4 và của O: 1s22s22p4
Đúng 0
Bình luận (0)
Hợp chất Z được tạo bởi hai nguyên tố X và Y có công thức X Y 2 trong đó Y chiếm 72,73% về khối lượng. Biết rằng trong phân tử Z, tổng số hạt (proton, nơtron, electron) là 66, số proton là 22. Nguyên tố Y là
A. cacbon
B. oxi
C. lưu huỳnh
D. magie
Mỗi phân tử XY2 có tổng các hạt proton, nơtron, electron bằng 178; trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 54, số hạt mang điện của X ít hơn số hạt mang điện của Y là 12. Hãy xác định kí hiệu hoá học của X,Y lần lượt là A. Fe và S B. S và O C. C và O D.Pb và Cl
Đọc tiếp
Mỗi phân tử XY2 có tổng các hạt proton, nơtron, electron bằng 178; trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 54, số hạt mang điện của X ít hơn số hạt mang điện của Y là 12. Hãy xác định kí hiệu hoá học của X,Y lần lượt là
A. Fe và S
B. S và O
C. C và O
D.Pb và Cl
Đáp án A
Kí hiệu số đơn vị điện tích hạt nhân của X là ZX , Y là ZY ; số nơtron (hạt không mang điện) của X là NX, Y là NY . Với XY2 , ta có các phương trình:
tổng các hạt proton, nơtron, electron bằng 178
→ 2 ZX + 4 ZY + NX + 2 NY = 178 (1)
số hạt mang điện nhiều hơn số hạt không mang điện là 54
→ 2 ZX + 4 ZY - NX 2 NY = 54 (2)
số hạt mang điện của X ít hơn số hạt mang điện của Y là 12
→ 4 ZY - 2 ZX = 12 (3)
→ ZY = 16 ; ZX = 26
Vậy X là sắt, Y là lưu huỳnh. XY2 là FeS2
Đúng 0
Bình luận (0)
Mỗi phân tử
X
Y
2
có tổng các hạt proton, nơtron, electron bằng 178; trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 54, số hạt mang điện của X ít hơn số hạt mang điện của Y là 12. Hãy xác định kí hiệu hoá học của X,Y lần lượt là A. Fe và S B. S và O C. C và O D. Pb và Cl
Đọc tiếp
Mỗi phân tử X Y 2 có tổng các hạt proton, nơtron, electron bằng 178; trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 54, số hạt mang điện của X ít hơn số hạt mang điện của Y là 12. Hãy xác định kí hiệu hoá học của X,Y lần lượt là
A. Fe và S
B. S và O
C. C và O
D. Pb và Cl
A
Kí hiệu số đơn vị điện tích hạt nhân của X là Z X , Y là Z Y ; số nơtron (hạt không mang điện) của X là N X , Y là N Y . Với X Y 2 , ta có các phương trình:
Tổng các hạt proton, nơtron, electron bằng 178
→ 2 Z X + 4 Z Y + N X + 2 N Y = 178 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 54
→ 2 Z X + 4 Z Y - N X - 2 N Y = 54 (2)
Số hạt mang điện của X ít hơn số hạt mang điện của Y là 12 → 4 Z Y - 2 Z X = 12 (3)
Từ (1); (2) và (3) → Z Y = 16 ; Z X = 26
Vậy X là sắt, Y là lưu huỳnh. X Y 2 l à F e S 2
Đúng 0
Bình luận (0)
Hợp chất Y có công thức M4X3. Biết: − Tổng số hạt trong phân tử Y là 214 hạt. − Ion M3+ có số electron bằng số electron của ion X4 − − Tổng số hạt proton, nơtron, electron của nguyên tử nguyên tố M nhiều hơn tổng số hạt của nguyên tử nguyên tố X trong Y là 106. Y là chất nào dưới đây? A. Al4Si3 B. Fe4Si3 C. Al4C3 D. Fe4C3
Đọc tiếp
Hợp chất Y có công thức M4X3. Biết:
− Tổng số hạt trong phân tử Y là 214 hạt.
− Ion M3+ có số electron bằng số electron của ion X4 −
− Tổng số hạt proton, nơtron, electron của nguyên tử nguyên tố M nhiều hơn tổng số hạt của nguyên tử nguyên tố X trong Y là 106. Y là chất nào dưới đây?
A. Al4Si3
B. Fe4Si3
C. Al4C3
D. Fe4C3
Đáp án C.
Tổng số hạt trong phân tử Y là 214 hạt.
4(2pM + nM) + 3(2pX + nX) = 214 (1)
Ion M3+ có số electron bằng số electron của ion X4 −
pM - 3 = pX + 4 => pX = pM - 7 (2)
Tổng số hạt proton, nơtron, electron của nguyên tử nguyên tố M nhiều hơn tổng số hạt của nguyên tử nguyên tố X trong Y là 106
4(2pM + nM) - 3(2pX + nX) = 106 (3)
(1), (3) => 2pM + nM = 40 (4) và 2pX + nX = 18 (5)
(5),(2),(4) => pX = 6 ; pM = 13 => X là C (Carbon) và M là Al (Nhôm)
Y la Al4C3 (Nhôm carbua)
Đúng 1
Bình luận (0)