Giúp mk vs
Đề là xác định chất khử chất oxi hoá ghi rõ quá trình khử và quá trình oxi hoá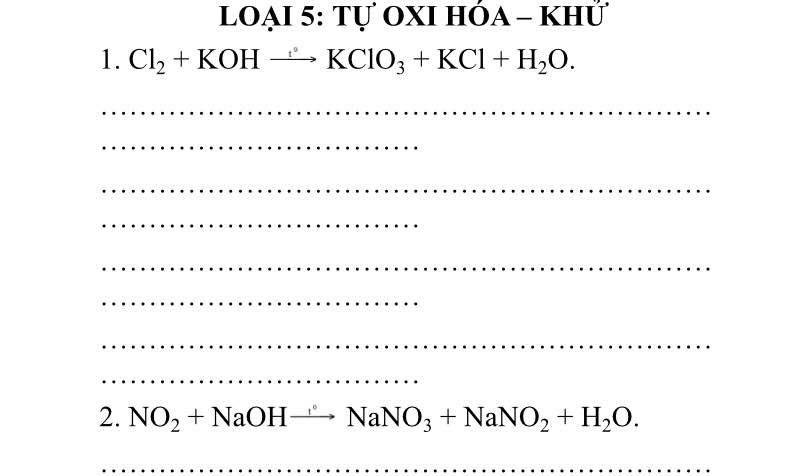

Những câu hỏi liên quan
Giúp mk vs
Đề là : xác định chất khử chất oxi hoá ghi rõ quá trình khử và quá trình oxi hoá
1) (5x-2y)Fe + (18x-6y)HNO3 --> (5x-2y)Fe(NO3)3 + 3NxOy + (9x-3y)H2O
Chất khử: Fe
Chất oxh: HNO3
| QT oxh | Fe0 -3e --> Fe+3 | x(5x-2y) |
| QT khử | xN+5 + (5x-2y)--> \(N_x^{+\dfrac{2y}{x}}\) | x3 |
2) 2M + 2nH2SO4 --> M2(SO4)n + nSO2 + 2nH2O
Chất khử: M
Chất oxh: H2SO4
| QT oxh | 2M0 -2ne --> M2+n | x1 |
| QT khử | S+6 + 2e --> S+4 | xn |
Đúng 2
Bình luận (0)
Giúp mk vs
Đề : xác định chất khử chất oxi hoá và ghi rõ quá trình khử và quá trình oxi hoá
1. \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
Chất khử: KClO3; Chất oxh: KClO3
| QT khử | Cl+5 +6e-->Cl-1 | x2 |
| QT oxh | 2O-2 -4e --> O20 | x3 |
2. 2Mg(NO3)2 --to--> 2MgO + 4NO2 + O2
Chất khử: Mg(NO3)2; Chất oxh: Mg(NO3)2
| QT khử | N+5 +1e --> N+4 | x4 |
| QT oxh | 2O-2 -4e --> O20 | x1 |
Đúng 0
Bình luận (0)
Cân bằng PTHH của các phản ứng oxi hoá- khử sau bằng phương pháp thăng bằng electron (xác định chất khử, chất oxi hoá, quá trình khử, quá trình oxi hóa).
A
l
+
H
N
O
3
→
A
l
N
O
3
3
+
N
O
+
N
H
4...
Đọc tiếp
Cân bằng PTHH của các phản ứng oxi hoá- khử sau bằng phương pháp thăng bằng electron (xác định chất khử, chất oxi hoá, quá trình khử, quá trình oxi hóa).
A l + H N O 3 → A l N O 3 3 + N O + N H 4 N O 3 + H 2 O
Cân bằng PTHH của các phản ứng oxi hoá- khử sau bằng phương pháp thăng bằng electron (xác định chất khử, chất oxi hoá, quá trình khử, quá trình oxi hóa).
C
u
+
H
2
S
O
4
đ
,
n
→
C
u
S
O
4
+
S
O...
Đọc tiếp
Cân bằng PTHH của các phản ứng oxi hoá- khử sau bằng phương pháp thăng bằng electron (xác định chất khử, chất oxi hoá, quá trình khử, quá trình oxi hóa).
C u + H 2 S O 4 đ , n → C u S O 4 + S O 2 + H 2 O
Cân bằng PTHH của các phản ứng oxi hoá- khử sau bằng phương pháp thăng bằng electron (xác định chất khử, chất oxi hoá, quá trình khử, quá trình oxi hóa).
1) KClO3+HCl --> KCl +Cl2+H2O
2)K2Cr2O7 +HCl -->KCl+CrCl3 +Cl2+H2O
3) KMnO4 +HCl --> KCl+MnCl2+Cl2+H2O
4)Al+HNO3 --> Al(NO3)3+N2O+H2O
5)Fe3O4 +HNO3 -->Fe(NO3)3 +NO+H2O
6) FeS +O2 --> Fe2O3 +SO2
giúp mình với
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường tổng số e nhậnB 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)Mg + H2SO 4 → MgSO4 + H2S + H2O.
Đọc tiếp
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.
B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.
B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường = tổng số e nhận
B 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)
Mg + H2SO 4 → MgSO4 + H2S + H2O.
\(B1.\overset{0}{Mg}+H_2\overset{+6}{S}O_4\rightarrow\overset{2+}{Mg}SO_4+H_2\overset{2-}{S}+H_2O\\ B2+B3.QToxh:Mg\rightarrow Mg^{2+}+2e|\times4\\ QTkhử:S^{+6}+8e\rightarrow S^{2-}|\times1\\ B4.4Mg+5H_2SO_4\rightarrow4MgSO_4+H_2S+4H_2O\)
Đúng 3
Bình luận (3)
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường tổng số e nhậnB 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)6. Al + HNO3 → Al(NO3)3+ N2O + H2O.7. FeSO4+ H2SO4+ KMnO4 → Fe2(SO4)3+ MnSO4+ K2SO4 + H2O.8. KMnO4+ HCl → KCl + MnCl2...
Đọc tiếp
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.
B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.
B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường = tổng số e nhận
B 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)
6. Al + HNO3 → Al(NO3)3+ N2O + H2O.
7. FeSO4+ H2SO4+ KMnO4 → Fe2(SO4)3+ MnSO4+ K2SO4 + H2O.
8. KMnO4+ HCl → KCl + MnCl2 + Cl2+ H2O.
9. K2Cr2O7+ HCl → KCl + CrCl3+ Cl2 + H2O.
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường tổng số e nhậnB 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)3. Mg + H2SO4 → MgSO4 + H2S + H2O.4. Al + HNO3 → Al(NO3)3 + NH4NO3+ H2O.5. Fe3O4+ HNO3 → Fe(NO3)3+ N2O + H2O.
Đọc tiếp
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.
B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.
B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường = tổng số e nhận
B 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)
3. Mg + H2SO4 → MgSO4 + H2S + H2O.
4. Al + HNO3 → Al(NO3)3 + NH4NO3+ H2O.
5. Fe3O4+ HNO3 → Fe(NO3)3+ N2O + H2O.
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường tổng số e nhậnB 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)7. FeSO4+ H2SO4+ KMnO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
Đọc tiếp
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.
B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.
B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường = tổng số e nhận
B 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)
7. FeSO4+ H2SO4+ KMnO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.











