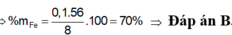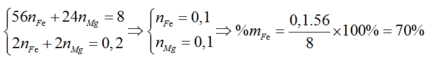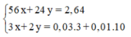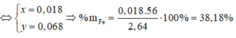khi hòa tan 15,4 g hợp kim gồm Mg và Zn trong H2SO4 loãng dư thì tạo thành 6,72 lít khí H2 (đktc). Thành phần phần trăm theo khối lượng của Mg là bao nh?

Những câu hỏi liên quan
Hòa tan hoàn toàn hợp kim Al - Mg trong dung dịch HCl, thu được 8,96 lít khí H2 (đktc). Nếu cũng cho một lượng hợp kim như trên tác dụng với dung dịch NaOH dư, thu được 6,72 lít khí H2 (đktc). Thành phần phần trăm theo khối lượng của Al trong hợp kim là A. 69,2%. B. 65,4%. C. 80,2%. D. 75,4%.
Đọc tiếp
Hòa tan hoàn toàn hợp kim Al - Mg trong dung dịch HCl, thu được 8,96 lít khí H2 (đktc). Nếu cũng cho một lượng hợp kim như trên tác dụng với dung dịch NaOH dư, thu được 6,72 lít khí H2 (đktc). Thành phần phần trăm theo khối lượng của Al trong hợp kim là
A. 69,2%.
B. 65,4%.
C. 80,2%.
D. 75,4%.
Đáp án : A
+) HCl : Al -> 1,5H2
Mg -> H2
+) NaOH : Al -> 1,5H2
=> nAl = 2/3 nH2 = 0,2 mol
=> nMg = nH2(1) – nH2(Al) = 0,4 – 0,3 = 0,1 mol
=> %mAl = 69,23%
Đúng 0
Bình luận (0)
Hòa tan 5,0 gam hỗn hợp hai kim loại Mg, Cu vào dung dịch H2SO4 loãng dư, người ta thu được 1,12 lít khí H2 (đktc). Thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp ban đầu là:
(Cho Mg =24; Cu = 64; S =32; O =16; H = 1)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
tl1..........1................1.............1(mol)
br x.......x................x.............x(mol)
\(Cu+H_2SO_4\rightarrow CuSO_4+H_2\)
tl1............1...............1...........1(mol)
Br y...........y...............y...........y(mol)
\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Taco hệ pt
\(\left\{{}\begin{matrix}x+y=0,05\\24x+64y=5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,045\\y=0,095\end{matrix}\right.\)
\(\Rightarrow\%m_{Mg}=0,045.24:5.100\%=21,6\%\)
\(\Rightarrow\%m_{Cu}=100\%-21,6\%=78,4\%\)
Đúng 5
Bình luận (0)
Hòa tan hết 8 gam hỗn hợp X gồm Fe và Mg bằng dung dịch H2SO4 loãng, dư thu được 4,48 lít khí H2 ở đktc. Phần trăm khối lượng của Fe trong hỗn hợp X là: A. 30%.. B. 70%. C. 56% D. 44%
Đọc tiếp
Hòa tan hết 8 gam hỗn hợp X gồm Fe và Mg bằng dung dịch H2SO4 loãng, dư thu được 4,48 lít khí H2 ở đktc. Phần trăm khối lượng của Fe trong hỗn hợp X là:
A. 30%..
B. 70%.
C. 56%
D. 44%
Hòa tan hết 8 gam hỗn hợp X gồm Fe và Mg bằng dung dịch H2SO4 loãng, dư thu được 4,48 lít khí H2 ở đktc. Phần trăm khối lượng của Fe trong hỗn hợp X là
A. 30%.
B. 70%.
C. 56%.
D. 44%.
Hoà tan 9 g hợp kim nhôm – magiê vào dung dịch H 2 S O 4 dư thu được 10,08 lít khí H 2 (đktc). Thành phần % khối lượng của Al và Mg trong hợp kim lần lượt là:
A. 50% và 50%
B. 40% và 60%
C. 60% và 40%
D. 39% và 61%
Hoà tan 2,64 gam hỗn hợp Fe và Mg bằng dung dịch HNO3 loãng, dư, thu được sàn phẩm khử là 0,896 lít (ở đktc) hỗn hợp khí gồm NO và N2, có tỷ khối so với H2 bằng 14,75. Thành phần phần trăm theo khối lượng của sắt trong hỗn hợp ban đầu là A. 61,80%. B. 61,82%. C. 38,18%. D. 38,20%.
Đọc tiếp
Hoà tan 2,64 gam hỗn hợp Fe và Mg bằng dung dịch HNO3 loãng, dư, thu được sàn phẩm khử là 0,896 lít (ở đktc) hỗn hợp khí gồm NO và N2, có tỷ khối so với H2 bằng 14,75. Thành phần phần trăm theo khối lượng của sắt trong hỗn hợp ban đầu là
A. 61,80%.
B. 61,82%.
C. 38,18%.
D. 38,20%.
Hoà tan 2,64 gam hỗn hợp Fe và Mg bằng dung dịch HNO3 loãng, dư, thu được sàn phẩm khử là 0,896 lít (ở đktc) hỗn hợp khí gồm NO và N2, có tỷ khối so với H2 bằng 14,75. Thành phần phần trăm theo khối lượng của sắt trong hỗn hợp ban đầu là A. 61,80%. B. 61,82%. C. 38,18%. D. 38,20%.
Đọc tiếp
Hoà tan 2,64 gam hỗn hợp Fe và Mg bằng dung dịch HNO3 loãng, dư, thu được sàn phẩm khử là 0,896 lít (ở đktc) hỗn hợp khí gồm NO và N2, có tỷ khối so với H2 bằng 14,75. Thành phần phần trăm theo khối lượng của sắt trong hỗn hợp ban đầu là
A. 61,80%.
B. 61,82%.
C. 38,18%.
D. 38,20%.
Cho 12,6 gam hợp kim gồm al và mg tác dụng hoàn toàn với dd H2so4 loãng, tạo ra 13,4 lít khí h2. viết các phương trình hóa học và tính:
a) thành phần phần trăm khối lượng mỗi kim loại trong hợp kim
b) khối lượng dd h2so4 20% tối thiểu cần dùng là
Gọi mol của Mg và Al là x, y mol
=> 24x + 27y = 12,6 (1)
nH2 = 0,6 mol => x + 1,5y = 0,6 (2)
Từ (1) (2) => x = 0,3 ; y = 0,2
=> %Mg = 57,14%
=> %Al = 42,86%
Đúng 2
Bình luận (0)
1/ Cho 0,83g hổn hợp gồm Al và Fe tác dụng với dd H2SO4 loãng dư, sau phản ứng thu được 0,56 lit khí ( đktc)a) Viết phương trình phản ứng.b) Tính thành phần % theo khối lượng của hổn hợp ban đầu.2/ Hòa tan 4,5g hợp kim Al - Mg trong dd H2SO4 loãng dư, thấy có 5,04 lít khí H2 bay ra ( đktc).a) Viết phương trình phản ứng hóa học xãy ra.b) Tính thành phần % khối lượng của mỗi kim loại trong hổn hợp ban đầu. Dạng: PHƯƠNG PHÁP HAI DÒNG1/ Cho 9,2g một kim loại A phản ứng với khí...
Đọc tiếp
1/ Cho 0,83g hổn hợp gồm Al và Fe tác dụng với dd H2SO4 loãng dư, sau phản ứng thu được 0,56 lit khí ( đktc)
a) Viết phương trình phản ứng.
b) Tính thành phần % theo khối lượng của hổn hợp ban đầu.
2/ Hòa tan 4,5g hợp kim Al - Mg trong dd H2SO4 loãng dư, thấy có 5,04 lít khí H2 bay ra ( đktc).
a) Viết phương trình phản ứng hóa học xãy ra.
b) Tính thành phần % khối lượng của mỗi kim loại trong hổn hợp ban đầu.
Dạng: PHƯƠNG PHÁP HAI DÒNG
1/ Cho 9,2g một kim loại A phản ứng với khí clo (dư) tạo thành 23,4g muối. Xác định tên kim loại A, biết A có hóa trị I
Câu 1:
Đặt \(n_{Al}=x(mol);n_{Fe}=y(mol)\Rightarrow 27x+56y=0,83(1)\)
\(n_{H_2}=\dfrac{0,56}{22,4}=0,025(mol)\\ 2Al+3H_2SO_4\to Al_2(SO_4)_3+3H_2\\ Fe+H_2SO_4\to FeSO_4+H_2\\ \Rightarrow 1,5x+y=0,025(2)\\ (1)(2)\Rightarrow x=y=0,01(mol)\\ \Rightarrow \%_{Al}=\dfrac{0,01.27}{0,83}.100\%=32,53\%\\ \Rightarrow \%_{Fe}=100\%-32,53\%=67,47\%\)
Câu 2:
Đặt \(n_{Al}=x(mol);n_{Mg}=y(mol)\Rightarrow 27x+24y=4,5(1)\)
\(n_{H_2}=\dfrac{5,04}{22,4}=0,225(mol)\\ 2Al+3H_2SO_4\to Al_2(SO_4)_3+3H_2\\ Mg+H_2SO_4\to MgSO_4+H_2\\ \Rightarrow 1,5x+y=0,225(2)\\ (1)(2)\Rightarrow x=0,1(mol);y=0,075(mol)\\ \Rightarrow \%_{Al}=\dfrac{0,1.27}{4,5}.100\%=60\%\\ \Rightarrow \%_{Mg}=100\%-60\%=40\%\)
Dạng PP hai dòng:
\(PTHH:2A+Cl_2\to 2ACl\\ \Rightarrow n_A=n_{ACl}\\ \Rightarrow \dfrac{9,2}{M_A}=\dfrac{23,4}{M_A+35,5}\\ \Rightarrow M_A=23(g/mol)\)
Vậy A là natri
Đúng 3
Bình luận (0)