Điện phân nước ta hỗn hợp khí H2 và O2.Tính tỉ khối của hỗn hợp khí này so với khí CH4

Những câu hỏi liên quan
đốt cháy 25 lít hỗn hợp khí a gồm ch4 và c2h6 trong bình đựng 95 lít khí o2. sau phản ứng thu được 60 lít hỗn hợp khí b gồm co2 và o2. tỉ khối của hỗn hợp khí tạo thành so với h2 là 20,5. Tính thành phần % thể tích hỗn hợp ban đầu. Tính tỉ khối của A so với B
Giả sử các khí được đo ở điều kiện sao cho 1 mol khí chiếm thể tích 1 lít
Gọi số mol CH4, C2H6 là a, b (mol)
=> \(a+b=\dfrac{25}{1}=25\left(mol\right)\) (1)
\(n_{O_2}=\dfrac{95}{1}=95\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
a---->2a---------->a
2C2H6 + 7O2 --to--> 4CO2 + 6H2O
b------>3,5b-------->2b
=> \(\left\{{}\begin{matrix}n_{O_2\left(dư\right)}=95-2a-3,5b\left(mol\right)\\n_{CO_2}=a+2b\left(mol\right)\end{matrix}\right.\)
=> \(95-a-1,5b=\dfrac{60}{1}=60\)
=> a + 1,5b = 35 (2)
(1)(2) => a = 5; b = 20
=> \(\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{5}{25}.100\%=20\%\\\%V_{C_2H_6}=\dfrac{20}{25}.100\%=80\%\end{matrix}\right.\)
\(\overline{M}_A=\dfrac{5.16+20.30}{5+20}=27,2\left(g/mol\right)\)
\(\overline{M}_B=20,5.2=41\left(g/mol\right)\)
=> \(d_{A/B}=\dfrac{27,2}{41}\approx0,663\)
Đúng 1
Bình luận (0)
Hỗn hợp khí X gồm
O
2
và
O
3
, tỉ khối của X so với
H
2
là 17,6. Hỗn hợp khí Y gồm
C
2
H
4
và
CH
4
, tỉ khối của Y so với
H
2
là 11. Thể tích hỗn hợp khí X (đ...
Đọc tiếp
Hỗn hợp khí X gồm O 2 và O 3 , tỉ khối của X so với H 2 là 17,6. Hỗn hợp khí Y gồm C 2 H 4 và CH 4 , tỉ khối của Y so với H 2 là 11. Thể tích hỗn hợp khí X (đktc) tối thiểu cần dùng để đốt cháy hoàn toàn 0,044 mol hỗn hợp khí Y là :
A. 3,36 lít
B. 2,24 lít
C. 1,12 lít
D. 4,48 lít
Đáp án B
Nhận thấy :
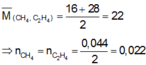
Quy đổi O2 và O3 thành O. Theo bảo toàn electron và bảo toàn khối lượng, ta có :
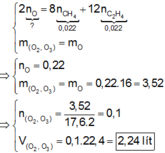
Đúng 1
Bình luận (0)
Hỗn hợp khí A gồm H2 và CH4 có tỉ khối so với khí hidro là 2,75 . Trộn V lít khí O2 với 8,8g hỗn hợp A được hỗn hợp khí B. Tỉ Khối của hỗn hợp B so với khí hidro là 9,375 . Cung cấp nhiệt thực hiện phản ứng cháy hỗn hợp B, phản ứng xong làm lạnh sản phẩm thu được nước và hỗn hợp khí D.a) Tính thành phần % theo thể tích mỗi khí trong hỗn hợp A,B? Tính giá trị V( ở đktc)b) Tính thể tích nước thu được ở thể lỏng và thành phần % theo khối lượng mỗi chất trong D?c) Để cần V lít khí O2 (đktc) ở trên c...
Đọc tiếp
Hỗn hợp khí A gồm H2 và CH4 có tỉ khối so với khí hidro là 2,75 . Trộn V lít khí O2 với 8,8g hỗn hợp A được hỗn hợp khí B. Tỉ Khối của hỗn hợp B so với khí hidro là 9,375 . Cung cấp nhiệt thực hiện phản ứng cháy hỗn hợp B, phản ứng xong làm lạnh sản phẩm thu được nước và hỗn hợp khí D.
a) Tính thành phần % theo thể tích mỗi khí trong hỗn hợp A,B? Tính giá trị V( ở đktc)
b) Tính thể tích nước thu được ở thể lỏng và thành phần % theo khối lượng mỗi chất trong D?
c) Để cần V lít khí O2 (đktc) ở trên cần phân hủy bao nhiêu gam KMnO4. Biết hiệu suất phản ứng phân hủy đạt 80%
Hỗn hợp A gồm CH4 và O2 có tỉ khối với H2 là 12
a, tính % về thể tích và về khối lượng của hỗn hợp A
b, gây nổ 16,8l hỗn hợp A rồi làm lạnh sản phẩm thu được m gam nước và V lít khí B. tính tỉ khối của hỗn hợp B với CH4
a) Ta có: \(\overline{M}=12\cdot2=24\)
Theo phương pháp đường chéo: \(n_{CH_4}=n_{O_2}\) \(\Rightarrow\%V_{CH_4}=\%V_{O_2}=50\%\)
Giả sử \(n_{O_2}=n_{CH_4}=1\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{O_2}=\dfrac{32}{32+16}\cdot100\%\approx66,67\%\\\%m_{CH_4}=33,33\%\end{matrix}\right.\)
b) Ta có: \(n_{O_2}=n_{CH_4}=\dfrac{\dfrac{16,8}{22,4}}{2}=0,375\left(mol\right)\)
PTHH: \(CH_4+3O_2\xrightarrow[]{t^o}CO_2+2H_2O\)
Theo PTHH: \(n_{CO_2}=n_{CH_4}=0,375\left(mol\right)\)
\(\Rightarrow d_{hh/CH_4}=\dfrac{44\cdot0,375+32\cdot0,375}{16}=1,78125\)
Đúng 1
Bình luận (0)
Bài 1. a) Tính tỉ khối hơi của khí SO2 so với khí O2 N2, SO3, CO, N2O, NO2.b) Tính tỉ khối hơi của hỗn hợp khí A gồm SO2 và O2 có tỉ lệ mol 1:1 đối với khí O2.Bài 2. a) Tính tỉ khối hơi của hỗn hợp khí X gồm hai khí N2 và CO đối với khí metan CH4. Hỗn hợp X nặng hay nhẹ hơn không khí?b) Tính tỉ khối hơi của hỗn hợp Y đồng khối lượng gồm khí C2H4 (etilen), N2 và khí CO so với khí H2.c) Hỗn hợp khí X gồm: NO, NxO, CH4. Trong đó NO chiếm 30% về thể tích, NxO chiếm 30% còn lại là CH4. Trong hỗn hợp...
Đọc tiếp
Bài 1. a) Tính tỉ khối hơi của khí SO2 so với khí O2 N2, SO3, CO, N2O, NO2.
b) Tính tỉ khối hơi của hỗn hợp khí A gồm SO2 và O2 có tỉ lệ mol 1:1 đối với khí O2.
Bài 2. a) Tính tỉ khối hơi của hỗn hợp khí X gồm hai khí N2 và CO đối với khí metan CH4. Hỗn hợp X nặng hay nhẹ hơn không khí?
b) Tính tỉ khối hơi của hỗn hợp Y đồng khối lượng gồm khí C2H4 (etilen), N2 và khí CO so với khí H2.
c) Hỗn hợp khí X gồm: NO, NxO, CH4. Trong đó NO chiếm 30% về thể tích, NxO chiếm 30% còn lại là CH4. Trong hỗn hợp CH4 chiếm 22,377% về khối lượng. Xác định công thức hoá học của NxO. Tính tỷ khối của X so với không khí
Bài 2:
a) Vì khối lượng mol của N2 và CO đều bằng 28 và lớn hơn khối lượng mol của khí metan CH4 (28>16)
=> \(d_{\dfrac{hhX}{CH_4}}=\dfrac{28}{16}=1,75\)
Hỗn hợp X nhẹ hơn không khí (28<29)
b)
\(M_{C_2H_4}=M_{N_2}=M_{CO}=28\left(\dfrac{g}{mol}\right)\\ \rightarrow M_{hhY}=28\left(\dfrac{g}{mol}\right)\\ d_{\dfrac{Y}{H_2}}=\dfrac{28}{2}=14\)
c) \(\%V_{NO}=100\%-\left(30\%+30\%\right)=40\%\\ \rightarrow\%n_{CH_4}=40\%\\ Vì:\%m_{CH_4}=22,377\%\\ Nên:\dfrac{30\%.16}{40\%.30+30\%.16+30\%.\left(x.14+16\right)}=22,377\%\\ \Leftrightarrow x=-0,03\)
Sao lại âm ta, để xíu anh xem lại như nào nhé.
Đúng 2
Bình luận (4)
Bài 1:
\(a.\\ d_{\dfrac{SO_2}{O_2}}=\dfrac{64}{32}=2\\ d_{\dfrac{SO_2}{N_2}}=\dfrac{64}{28}=\dfrac{16}{7}\\ d_{\dfrac{SO_2}{SO_3}}=\dfrac{64}{80}=0,8\\ d_{\dfrac{SO_2}{CO}}=\dfrac{64}{28}=\dfrac{16}{7}\\ d_{\dfrac{SO_2}{N_2O}}=\dfrac{64}{44}=\dfrac{16}{11}\\ d_{\dfrac{SO_2}{NO_2}}=\dfrac{64}{46}=\dfrac{32}{23}\\ b.M_{hhA}=\dfrac{1.64+1.32}{1+1}=48\left(\dfrac{g}{mol}\right)\\ d_{\dfrac{hhA}{O_2}}=\dfrac{48}{32}=1,5\)
Đúng 4
Bình luận (2)
Tỉ khối của hỗn hợp khí A gồm khí metan (CH4) và Oxi đối với khí Hidro là 14,4. Bật tia lửa điện để đốt cháy hoàn toàn khí metan thì thu được hỗn hợp khí B và hơi nước. Tính tỉ khối của B so với A.
Gọi số mol CH4, O2 là a, b (mol)
Có: \(\overline{M}_A=\dfrac{16a+32b}{a+b}=14,4.2=28,8\left(g/mol\right)\)
=> 12,8a = 3,2b
=> a : b = 1 : 4
Giả sử A gồm 1 mol CH4 và 4 mol O2
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
Xét tỉ lệ: \(\dfrac{1}{1}< \dfrac{4}{2}\) => CH4 hết, O2 dư
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
1---->2----------->1
=> \(B\left\{{}\begin{matrix}CO_2:1\left(mol\right)\\O_{2\left(dư\right)}=4-2=2\left(mol\right)\end{matrix}\right.\)
=> \(\overline{M}_B=\dfrac{1.44+2.32}{1+2}=36\left(g/mol\right)\)
=> \(d_{B/A}=\dfrac{36}{28,8}=1,25\)
Đúng 1
Bình luận (0)
tỉ khối của hỗn hợp A gồm H2 và CH4 đối với khí H2 là 3,625. trộn 22,4 lít khí O2 với 17,92 l khí hỗn hợp khí A rồi thực hiện phản ứng đốt cháy khi các phản ứng kết thúc làm lạnh để ngưng tụ hết hơi nước thu được hỗn hợp khí B biết các thể tích khí đều do ở điều kiện tiêu chuẩn
a Tính thành phần trăm theo thể tích mỗi khí trong hỗn hợp B
cho 8,96l hỗn hợp khí h2 và o2(đktc) có tỉ lệ 1:1. gây nổ hỗn hợp bằng tia lửa điện thu đc hh khí và hơi nước có tỉ khối so vs h2 =10. tính hiệu suất phản ứng
dhh2H2=Mhh22=10⇒Mhh2=20(g/mol)dhh2H2=Mhh22=10⇒Mhh2=20(g/mol)
Ta có pt: 18⋅2x+2(0,2−2x)+32(0,2−x)=20(2x+0,2−2x+0,2−x)18⋅2x+2(0,2−2x)+32(0,2−x)=20(2x+0,2−2x+0,2−x)
Giải pt ta được x=0,06x=0,06
Đúng 0
Bình luận (4)
Hỗn hợp khí A gồm có
O
2
và
O
3
tỉ khối của hỗn hợp khí A đối với khí
H
2
là 19,2. Hỗn hợp khí B gồm có
H
2
và khí CO, tỉ khối của hỗn hợp khí B đối với
H
2...
Đọc tiếp
Hỗn hợp khí A gồm có O 2 và O 3 tỉ khối của hỗn hợp khí A đối với khí H 2 là 19,2. Hỗn hợp khí B gồm có H 2 và khí CO, tỉ khối của hỗn hợp khí B đối với H 2 là 3,6.
Tính thành phần phần trăm theo thể tích của mỗi khí có trong hỗn hợp khí A và B.
Đặt x và y là số mol O 3 và O 2 có trong 1 mol hỗn hợp khí
Hỗn hợp khí A : (48x + 32y)/(x+y) = 19,2 x 2 = 38,4
→ 3x = 2y → 40% O 3 và 60% O 2
Đặt x và y là số mol H 2 và CO có trong 1 mol hỗn hợp khí
Hỗn hợp khí B : (2x + 28y)/(x+y) = 3,6 x 2 = 7,2
→ x = 4y → 80% H 2 và 20% CO
Đúng 0
Bình luận (1)
















