[2- 0,6] x [ 1 - 0,003]

Những câu hỏi liên quan
Viết các số sau dưới dạng phân số
0,6 ; 7,12 ; 6,15 ; 8,3 ;4,6 ; 12,34 ; 5,3 ; 8,02 ; 0,0013 ; 2,34 ; 3,005 ; 123,123 ; 0,075 ; 0,003 ; 1,00101 ; 2,005 ; 0,00001 ; 0,00001 ; 0,000234 ;1,010101 ; 2,02025 ; 0(1) ; 0(3)
a) x : 2,5 = 0,003 : 0,75
x:2,5=0,003:0,75
=>x:2,5= 0,004
=>x=0,004.2,5
=>x= 0,01
Vậy x=0,01
Đúng 0
Bình luận (0)
Kiểm tra xem giá trị x = -2 có là nghiệm của bất phương trình sau không?
a) x + 2x2 – 3x3 + 4x4 – 5 < 2x2 – 3x3 + 4x4 – 6;
b) (-0,001)x > 0,003.
a) x + 2x2 - 3x3 + 4x4 - 5 < 2x2 - 3x3 + 4x4 - 6
⇔ x < 2x2 - 3x3 + 4x4 - 6 - 2x2 + 3x3 - 4x4 + 5 (chuyển vế - đổi dấu)
⇔ x < -1 (*)
Vì -2 < -1 nên -2 là nghiệm của bất phương trình
Vậy x = -2 là nghiệm của bất phương trình.
b) (-0,001)x > 0,003
⇔ x < -3 (chia cả hai vế cho -0,001)
Vì -2 > -3 nên -2 không phải nghiệm của bất phương trình
Vậy x = -2 không là nghiệm của bất phương trình.
Đúng 0
Bình luận (0)
tìm x trong tỉ lệ thức
a,2,5:7,5=x:3/5
b,x:2,5=0,003:0,75
a)2,5:7,5=x:3/5
0,(3)=x:3/5
\(\Rightarrow\)x= 1/5
b)x:2,5=0,003;0,75
x:2,5=1/250
\(\Rightarrow\)x=1/100
Đúng 0
Bình luận (0)
Trong 100 ml dung dịch X có 0,003 mol Na+; 0,001 mol SO42− và x mol OH−. Tính pH của dung dịch X?
Bảo toàn điện tích :
$n_{OH^-} = 0,003 - 0,001.2 = 0,001(mol)$
$[OH^-] = \dfrac{0,001}{0,1} = 0,01M$
$pOH = -log(0,01) = 2$
$\Rightarrow pH = 14 - pOH = 14 - 2 = 12$
Đúng 1
Bình luận (0)
Tìm x trong các tỉ lệ thức :
a) \(x:2,5=0,003:0,75\)
b) \(\frac{2}{3}:0,4=x:\frac{4}{5}\)
a) x : 2,5 = 1/100
x = 1/250 * 2,5
x= 1/100
b) 5/3= x : 4/5
x= 4/5 * 5/3
x= 4/3
Đúng 0
Bình luận (0)
a) \(x\div2.5=0.003\div0.75\)
\(x\div2.5=0.004\)
\(x=0.004×2.5\)
\(x=0.01\)
Vậy, \(x=0.01\)
b) \(\frac{2}{3}\div0.4=x\div\frac{4}{5}\)
\(x\div\frac{4}{5}=\frac{5}{3}\)
\(x=\frac{5}{3}×\frac{4}{5}\)
\(x=\frac{20}{15}=\frac{4}{3}\)
Vậy, \(x=\frac{4}{3}\)
Cbht
Đúng 0
Bình luận (0)
a, Lời giải
\(x:2,5=\frac{1}{100}\)
\(x=\frac{1}{100}.2,5\)
\(x=\frac{1}{100}\)
b, Lời giải
\(\frac{5}{3}=x:\frac{4}{5}\)
\(x=\frac{4}{5}.\frac{5}{3}\)
\(x=\frac{4}{3}\)
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn hỗn hợp gồm 0,002 mol FeS2 và 0,003 mol FeS vào lượng dư dung dịch H2SO4 đặc nóng thu được Fe2(SO4)3, SO2 và H2O. Hấp thụ hết lượng SO2 trên bằng 1 lượng vừa đủ dung dịch KMnO4 thu được dung dịch X có pH 2. Thể tích của dung dịch X là A. 2,00 lít B. 1,150 lít C. 1,114 lít D. 2,28 lít
Đọc tiếp
Hòa tan hoàn toàn hỗn hợp gồm 0,002 mol FeS2 và 0,003 mol FeS vào lượng dư dung dịch H2SO4 đặc nóng thu được Fe2(SO4)3, SO2 và H2O. Hấp thụ hết lượng SO2 trên bằng 1 lượng vừa đủ dung dịch KMnO4 thu được dung dịch X có pH = 2. Thể tích của dung dịch X là
A. 2,00 lít
B. 1,150 lít
C. 1,114 lít
D. 2,28 lít
Cách 1: Quy đổi số oxi hóa
Sau toàn bộ quá trình, số oxi hóa cuối cùng của lưu huỳnh là +4 (trong SO2).
Giả sử S trong FeS2 và FeS đều là S + 4 .
Khi đó, có các quá trình nhường và nhận electron như sau:
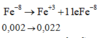
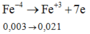
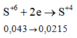

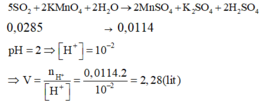
Đáp án D
Đúng 0
Bình luận (0)
Cho dung dịch X gồm: 0,007 mol Na+; 0,003 mol Ca2+; 0,006 mol Cl-; 0,006 và 0,001 mol. Để loại bỏ hết Ca2+ trong X cần một lượng vừa đủ dung dịch chứa a gam Ca(OH)2. Giá trị của a là A. 0,222 B. 0,120 C. 0,444 D. 0,180
Đọc tiếp
Cho dung dịch X gồm: 0,007 mol Na+; 0,003 mol Ca2+; 0,006 mol Cl-; 0,006 và 0,001 mol. Để loại bỏ hết Ca2+ trong X cần một lượng vừa đủ dung dịch chứa a gam Ca(OH)2. Giá trị của a là
A. 0,222
B. 0,120
C. 0,444
D. 0,180
Đáp án A
Gọi x là số mol Ca(OH)2 cần dùng
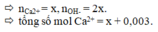
OH - + HCO3- → CO32- + H2O
2x 2x
Ca2+ + CO32-→ CaCO3
Để loại bỏ hết ion Ca2+ thì nCa2+ = nCO3(2-)
Đúng 0
Bình luận (0)
2 x 0,6 x ( 1+0,5 ) =
























