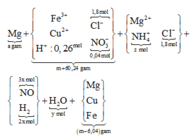
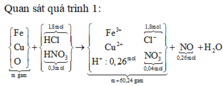
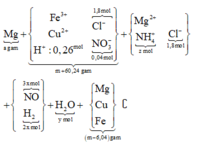
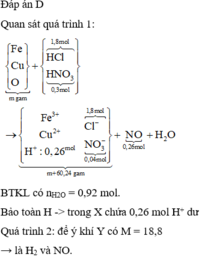
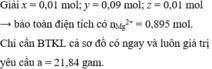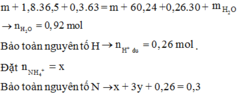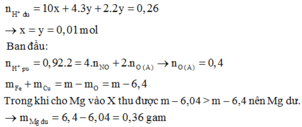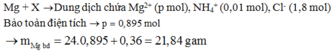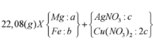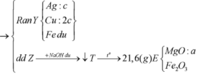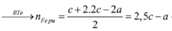Cho 10,72 gam hỗn hợp X gồm Cu và Mg vào 70 gam dung dịch H2SO4 77,0%. Kết thúc phản ứng thu được 5,824 lít khí duy nhất (đktc) và 2,24 gam rắn không tan. Mặt khác lấy a mol hỗn hợp X trên tác dụng hết với 180 gam dung dịch HNO3 28% thu được dung dịch Y chỉ chứa các muối có khối lượng 60,8 gam và thấy khí NO thoát ra. Giá trị của a là.
A. 0,35
B. 0,30
C. 0,40
D. 0,36