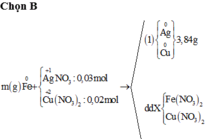
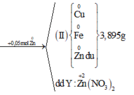
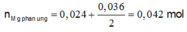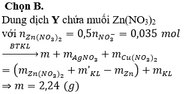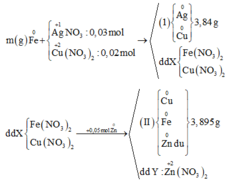Cho m gam hỗn hợp A gồm Fe và Zn vào 200 ml dung dịch chứa AgNO3 0,18M và Cu(NO3)2 0,12M, sau một thời gian thu được 4,21 gam chất rắn X và dung dịch Y. Cho 1,92 gam bột Mg vào dung dịch Y, sau khi phản ứng xảy ra hoàn toàn, thu được 4,826 gam chất rắn Z và dung dịch T. Giá trị của m là
A. 2,700
B. 3,124
C. 2,648
D. 3,280