Cho Al lần lượt vào các dung dịch : H 2 S O 4 loãng, H N O 3 (đậm đặc, t o ), B a O H 2 , H N O 3 loãng, H 2 S O 4 đặc, thấy sinh ra khí B có tỉ khối so với O 2 nhỏ hơn 0,8. Số dung dịch có thể phù hợp là
A. 2
B. 3
C. 4
D. 5
Cho Al lần lượt vào các dung dịch : H2SO4 loãng, HNO3 (đậm đặc, to), Ba(OH)2,HNO3 loãng, H2SO4 đặc, thấy sinh ra khí B có tỉ khối so với O2 nhỏ hơn 0,9. Số dung dịch phù hợp là :
A. 2.
B. 3.
C. 4.
D. 5
Ba(OH)2,HNO3 loãng,H2SO4 loãng,
Đáp án B
Cho Al lần lượt vào các dung dịch: H2SO4 loãng, HNO3 (đậm đặc, to), Ba(OH)2, HNO3 loãng, H2SO4 đặc, thấy sinh ra khí X có tỉ khối so với O2 nhỏ hơn 0,9. Số dung dịch phù hợp là
A. 2.
B. 3.
C. 4.
D. 5.
Đáp án B
Các dung dịch là: H2SO4 loãng, Ba(OH)2, HNO3 loãng
+ M X < 32 . 0 , 9 = 28 , 8 . + P h ư ơ n g t r ì n h p h ả n ứ n g : 2 A l + 3 H 2 S O 4 l o ã n g → A l 2 ( S O 4 ) 3 + 3 H 2 ↑ 2 A l + B a ( O H ) 2 + 2 H 2 O → B a ( A l O 2 ) 2 + 3 H 2 ↑ 10 A l + 36 H N O 3 l o ã n g → 10 A l ( N O 3 ) 3 + 3 N 2 ↑ + 18 H 2 O
Em muốn hỏi 3 bài tập như sau:
1,Cần bao nhiêu gam H2O để pha loãng 200ml dung dịch KOH 20% thành dung dịch KOH 16%?
2,Cần bao nhiêu ml H2O để pha loãng 50ml dung dịch H2SO4 2M thành dung dịch H2SO4 0,5M?
3,Trộn 200g dung dịch NaOH 10% với 300g dung dịch NaOH 60% thì thu được dung dịch có nồng độ như thế nào?
Các bạn giúp mình với mình cảm ơn
Đề bài 1 sai nhé:1,Cần bao nhiêu gam H2O để pha loãng 200g dung dịch KOH 20% thành dung dịch KOH 16%?
Gọi số g H2O thêm vào là a(g)
mKOH=\(200.\dfrac{20}{100}=40\left(g\right)\)
Ta có:
\(\dfrac{40}{200+m}.100\%=16\%\)
=>m=50(g)
2.
Gọi ml H2O thêm vào là a(lít)
nH2SO4=0,05.2=0,1(mol)
Ta có:
\(\dfrac{0,1}{a+0,05}=0,5\)
a=,15(lít)
3.
mNaOH(10%)=200.\(\dfrac{10}{100}\)=20(g)
mNaOH(60%)=\(300.\dfrac{60}{100}=180\left(g\right)\)
C% dd NaOH=\(\dfrac{180+20}{200+300}.100\%=40\%\)
Hòa tan hoàn toàn hỗn hợp m(g) hỗn hợp X gồm Cu và Fe3O4 trong 500ml dung dịch H2SO4 ( loãng ) nồng độ a (M) , thu được dung dịch Y. Cho Y tác dụng vừa đủ với dung dịch vừa đủ với 1,6 mol NaOH, thu được 52g kết tủa. Tính m, a ?
Cảm ơn trước
. Giúp mình câu hỏi này nhé <3
1
. a) Từ các chất KClO3 , Zn , Fe , H2SO4 loãng điều chế các chất sau : khí hidro, khí oxi, ZnO, FeSO4
b) Từ các chất sau : Al, Fe , S , KClO3 viết phương trình hóa học điều chế các chất sau : Al2O3 , SO2 , ZnO, Fe3O4
c) Từ các chất H2SO4 loãng, Zn, KMnO4, P điều chế các chất : khí Hidro , khí oxi, nước , H3PO4
2.
Cho Nhôm tác dụng hết với dung dịch hết với dung dịch HCl thu được 26,7 g muối
a) Tính khối lượng Nhôm tham gia phản ứng ?
b) Tính thể tích H2 thu được ở đktc?
c) Lấy toàn bộ khí H2 thu được ở trên trộn với khí mêtan (không có phản ứng xảy ra ) thu được hỗn hợp A . Đốt cháy hoàn toàn A thu được 9g nước. Tính thể tích khí mêtan cần dùng ở đktc ?
#. Cuối cùng là cảm ơn các bạn nhiều <3
Câu 1:
a) - Điều chế O2:
.........2KClO3 --to--> 2KCl + 3O2
- Điều chế ZnO:
..........2Zn + O2 --to--> 2ZnO
- Điều chế H2, FeSO4:
..........Fe + H2SO4 (loãng) --> FeSO4 + H2
b) Pt: 2KClO3 --to--> 2KCl + 3O2
- Điều chế Al2O3:
..........4Al + 3O2 --to--> 2Al2O3
- Điều chế SO2:
...........S + O2 --to--> SO2
- Điều chế Fe3O4:
...........3Fe + 2O2 --to--> Fe3O4
c) - Điều chế H2:
............Zn + H2SO4 (loãng) --> ZnSO4 + H2
- Điều chế O2:
...........2KMnO4 --to--> K2MnO4 + MnO2 + O2
- Điều chế H2O:
...........2H2 + O2 --to--> 2H2O
- Điều chế H3PO4:
...........4P + 5O2 --to--> 2P2O5
...........P2O5 + 3H2O --> 2H3PO4
Câu 2:
nAlCl3 = \(\dfrac{26,7}{133,5}=0,2\) mol
Pt: 2Al + 6HCl --> 2AlCl3 + ....3H2
0,2 mol<----------- 0,2 mol-> 0,3 mol
mAl pứ = 0,2 . 27 = 5,4 (g)
VH2 = 0,3 . 22,4 = 6,72 (lít)
nH2O = \(\dfrac{9}{18}=0,5\) mol
Pt: .....2H2 + O2 --to--> 2H2O
...0,3 mol-------------> 0,3 mol
...CH4 + 2O2 --to--> CO2 + 2H2O
0,1 mol<--------------------(0,5 - 0,3) mol
VCH4 cần dùng = 0,1 . 22,4 = 2,24 (lít)
Cho các thí nghiệm sau:
(1) Điện phân dung dịch CuSO4 với điện cực trơ.
(2) Cho Al vào dung dịch H2SO4 loãng, nguội.
(3) Cho FeS vào dung dịch HCl.
(4) Sục khí CO2 vào dung dịch Na2SiO3.
(5) Đun nóng hỗn hợp rắn gồm C và Fe3O4.
(6) Đun sôi nước cứng tạm thời.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm tạo ra sản phẩm khí là
A. 4.
B. 5.
C. 6.
D. 2.
Bài 3: Cho các oxit: K2O, CO, BaO, CO2, Al2O3, Fe3O4, và SiO2. Viết các PTPƯ xảy ra (nếu có) khi cho các oxit trên lần lượt tác dụng với H2O, dung dịch H2SO4 loãng và dung dịch KOH
Bài 4: Cho các kim loại Fe, Al, Cu lần lượt tác dụng với Cl2 và các dung dịch sau: ZnSO4, AgNO3, H2SO4, KOH. Viết các PTPƯ xảy ra (nếu có)
Bài 5: Cho các kim loại Cu, Al, Fe, Ag. Kim loại nào tác dụng được với dung dịch HCl, dung dịch CuSO4, dung dịch AgNO3, dung dịch NaOH? Viết các PTPƯ xảy ra
Bài 3
+ H2O
K2O+H2O---.2KOH
BaO+H2O--->Ba(OH)2
CO2+H2O--->H2CO3
+H2SO4 loãng
K2O+H2SO4--->K2SO4+H2O
BaO+H2SO4--->BaSO4+H2O
Al2O3+3H2SO4--->Al2(SO4)3+3H2O
+ dd KOH
CO2+2KOH--->K2CO3+H2O
CO2+KOH--->KHCO3
SiO2+2KOH--->K2SiO3+H2O
Bài 4Cho các kim loại Fe, Al, Cu lần lượt tác dụng với Cl2 và các dung dịch sau: ZnSO4, AgNO3, H2SO4, KOH. Viết các PTPƯ xảy ra (nếu có)
2Fe+3Cl2-->2FeCl3
2Al+3Cl2--->2AlCl3
Cu+Cl2---->CuCl2
+ và các dd sau là sao nhỉ..mk chưa hiểu ý đề bài
bài 5 Cho các kim loại Cu, Al, Fe, Ag. Kim loại nào tác dụng được với dung dịch HCl, dung dịch CuSO4, dung dịch AgNO3, dung dịch NaOH? Viết các PTPƯ xảy ra
+dd HCl
2Al+6HCl-->2AlCl3+3H2
Fe+2HCl---->FeCl2+H2
+dd CuSO4
2Al+3CuSO4--->3Cu+Al2(SO4)3
Fe+CuSO4--->Cu+FeSO4
+dd AgNO3
Cu+2AgNO3--->2Ag+Cu(NO3)2
Al+3AgNO3--->3Ag+Al(NO3)3
Fe+2AgNO3--->2Ag+Fe(NO3)2
+ dd NaOH
2NaOH+2Al+2H2O--->2NaAlO2+3H2
Thực hiện các thí nghiệm sau:
(1) Đốt dây sắt trong khí clo.
(2) Đốt nóng hỗn hợp bột Fe và S (trong điều kiện không có oxi).
(3) Cho FeO vào dung dịch HNO 3 (loãng dư).
(4) Cho Fe vào dung dịch Fe 2 SO 4 3 .
(5) Cho Fe vào dung dịch H 2 SO 4 (loãng, dư).
Có bao nhiêu thí nghiệm tạo ra muối sắt(II)?
A. 3.
B. 1.
C. 2.
D. 4.
Đáp án A
Các phản ứng tạo ra muối sắt(II) là :
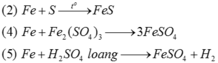
Hai phản ứng còn lại đều tạo ra muối sắt(III).
Dung dịch Y gồm: a mol Al3+, b mol Cl-, 0,15 mol H+ và 0,03 mol SO42-. Cho 180ml dung dịch Z gồm NaOH 1,2M và Ba(OH)2 0,1M vào dung dịch Y, sau khi các phản ứng xảy ra hoàn toàn, thu được 5,598 gam kết tủa. Giá trị của a, b lần lượt là: (Al=27, Cl=35,5, Ba=137, S=32, H=1, Na=23, O=16)
A. 0,030 và 0,018
B. 0,018 và 0,144
C. 0,180 và 0,030D. 0,030 và 0,180
D. 0,030 và 0,180
Đáp án : D
Bảo toàn điện tích : 3a + 0,15 = b + 0,06
nOH = 0,252 mol ; n B a 2 + = 0,018 mol < n S O 4
=> kết tủa gồm 0,018 mol BaSO4 và Al(OH)3
=> n A l O H 3 = 0,018 mol < 1 3 nOH
=> có hiện tượng hòa tan kết tủa
=> n A l O H 3 = 4 n A l 3 + - n O H - n H +
=> n A l 3 + = a = 0,03 mol
=> b = 0,18 mol