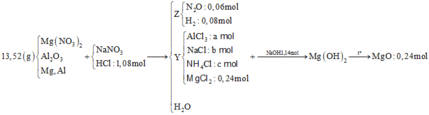
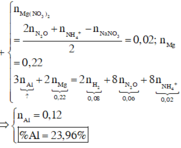
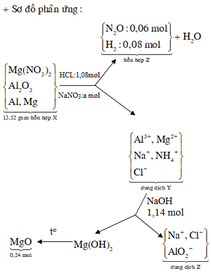
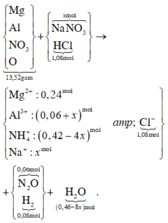
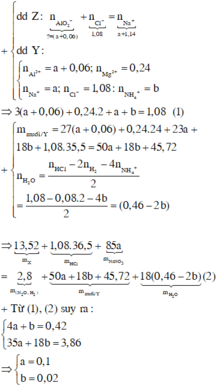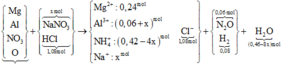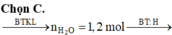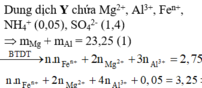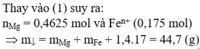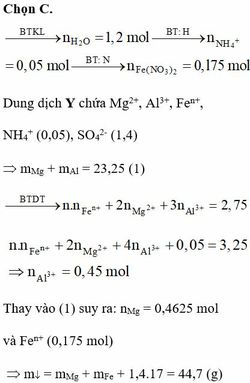Hòa tan hoàn toàn 27,04 gam hỗn hợp X gồm Mg, Al, Al2O3, Mg(NO3)2 vào dung dịch chứa hai chất tan NaNO3 và 1,08 mol H2SO4 (loãng). Sau khi kết thúc các phản ứng, thu được dung dịch Y chỉ chứa các muối và 0,28 mol hỗn hợp Z gồm N2O, H2. Tỷ khối của Z so với H2 bằng 10. Dung dịch Y tác dụng tối đa với dung dịch chứa 2,28 mol NaOH, thu được 27,84 gam kết tủa. Phần trăm khối lượng của nhôm kim loại có trong X là
A. 23,96%.
B. 31,95%.
C. 27,96%.
D. 15,09%.