Hòa tan hết 13,52 gam hỗn hợp X gồm Mg(NO3)2, Al2O3, Mg và Al vào dung dịch NaNO3 và 1,08 mol HCl (đun nóng). Sau khi kết thúc phản ứng thu được dung dịch Y chỉ chứa các muối và 3,136 lít (đktc) hỗn hợp khí Z gồm N2O và H2. Tỉ khối của Z so với He bằng 5. Dung dịch Y tác dụng tối đa với dung dịch chứa 1,14 mol NaOH, lấy kết tủa nung ngoài không khí tới khối lượng không đổi thu được 9,6 gam rắn. Phần trăm khối lượng của Al có trong hỗn hợp X là:
A. 31,95%.
B. 19,97%.
C. 23,96%.
D. 27,96%.
Đáp án C
Quan sát sơ đồ quá trình
quy đổi + xử lí:
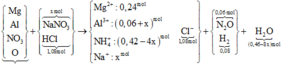
► NaOH vừa đủ xử lí "kép"
dung dịch sau phản ứng:
♦1: đọc ra chất rắn cuối cùng
là 0,24 mol MgO
→ biết ∑nMg
(vì thế mà chúng ta có xu hướng
quy đổi lại hỗn hợp X như trên sơ đồ).
♦2: Natri đi về đâu?
gọi nNaNO3 = x mol thì với
1,14 mol NaOH nữa là
∑nNa+ = 1,14 + x mol.
đi về NaCl và NaAlO2
Biết nCl = 1,08 mol nên đọc ra
nNaAlO2 = 0,06 + x mol.
Bảo toàn N có ngay và luôn
nNO3 trong X = (0,54 – 5x) mol.
có mỗi một giả thiết mX = 13,52 g
nên cần tìm nO trong X nữa là sẽ giải
và tìm được x.
♦1 Bảo toàn electron mở rộng:
∑nH+ = 10nN2O + 10nNH4+ + 2nH2 + 2nO trong X
♦2: bảo toàn H tìm nH2O rồi bảo toàn O
(ghép cụm NO3) => nO trong X
→ theo cả 2 cách đều cho biết
nO trong X = 20x – 1,94 mol.
Như phân tích trên:
giải mX = mMg + mAl + mO + mNO3
= 13,52 gam có x = 0,1 mol.
Từ đó đọc ra nO trong X = 0,06 mol
→ nAl2O3 = 0,02 mol; mà ∑nAl = 0,16 mol
→ nAl = 0,12 mol
→ Yêu cầu %mAl trong X ≈ 23,96 %.



