Thực hiện phản ứng giữa H 2 v à N 2 (tỉ lệ mol 4 : 1) trong bình kín có xúc tác, thu được hỗn hợp khi có áp suất giảm 9% so với ban đầu (trong cùng điều kiện). HIệu suất phản ứng là
A. 20%.
B. 22,5%.
C. 25%.
D. 27%.
Thực hiện phản ứng giữa H 2 và N 2 (tỉ lệ mol 4 : 1) trong bình kín có xúc tác, thu được hỗn hợp khi có áp suất giảm 9% so với ban đầu (trong cùng điều kiện). Hiệu suất phản ứng là
A. 20%
B. 22,5%.
C. 25%.
D. 27%.
Thực hiện phản ứng giữa N2 và H2 (tỉ lệ mol 1:4) trong bính kín có xúc tác, thu được hỗn hợp có áp suất giảm 10% so với ban đầu (cùng đk). Hiệu suất phản ứng là
A. 25%
B. 50%
C. 75%
D. 60%
Thực hiện phản ứng giữa H 2 và N 2 trong bình kín có xúc tác thu được 1,7 gam NH 3 với hiệu suất phản ứng là 80%. Thể tích H 2 (đktc) cần dùng cho phản ứng là (Cho: N = 14, H = 1)
A. 4,2 lít.
B. 2,4 lít.
C. 4 lít.
D. 5lít.
Chọn A
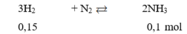
Do hiệu suất phản ứng là 80% nên thể tích H 2 cần dùng là:
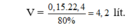
Câu 1: Thực hiện phản ứng giữa H2 và N2 (tỉ lệ mol 4:1), trong bình kín có xúc tác, thu được hỗn hợp khí có áp suất giảm 9% so với ban đầu ( trong cùng điều kiện). Tính Hiệu suất phản ứng.
Câu 2: Trộn 3 dung dịch HCl 0,3M; H2SO4 0,2M; và H3PO4 0,1M với những thể tích bằng nhau thu được dung dịch A. Để trung hòa 300ml dung dịch A cần vừa đủ V ml dung dịch B gồm NaOH 0,2M và Ba(OH)2 0,1M. Tính giá trị của V.
Câu 3: Hòa tan hoành toàn m gam Al trong dung dịch HNO3, thấy tạo ra 4,48 lít hỗn hợp 3 khí NO, N2, N2O (tỉ lệ mol nNO : nN2 : nN2O = 1:2:2) Thể tích dung dịch HNO3 1M cần bao nhiêu lít?
Câu 3: Gọi số mol NO là a . Có: n\(_{N_2}\) = n\(_{N_2O}\) = 2a => 5a = \(\dfrac{4,48}{22,4}\) = 0,2
=> a = 0,04 . Vậy: n\(HNO_3\) = a.4+2a.10+2a.12 = 1,92 (mol)
=> V\(_{HNO_3}\) = 1,92 (lít)
Cho V lít (đktc) hỗn hợp N2 và H2 có tỉ lệ mol 1:4 vào bình kín và đun nóng. Sau phản ứng thu được 1,5 mol NH3. Biết hiệu suất phản ứng là H= 25%. Giá trị của V là:
A. 42 lít
B. 268,8 lít
C. 336 lít
D. 448 lít
Đáp án B
![]()
Do 1 1 > 4 3 → Hiệu suất tính theo N 2
Đặt số mol N2 ban đầu là x mol
→ nH2 ban đầu= 4x mol;
Do hiệu suất phản ứng là 25% nên
nN2 pứ= 25%.x= 0,25x mol
![]()
Ban đầu x 4x mol
Phản ứng 0.25x 0.75x 0.5x mol
Sau pứ 0.75x 3.25x 0.5x mol
Sau phản ứng nNH3= 0,5x= 1,5 suy ra x=3 mol
→V= 22,4. (x+3x)= 22,4.4.3=268,8 lít
Cho V lít (đktc) hỗn hợp khí N 2 và H 2 có tỉ lệ mol 1:4 vào bình kín và nung nóng. Sau phản ứng thu được 1,5 mol NH 3 . Biết hiệu suất phản ứng là H = 25%. Giá trị của V là
A. 42 lít.
B. 268,8 lít.
C. 336 lít.
D. 448 lít.
Chọn C
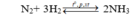
Giả sử phản ứng xảy ra với H = 100% → N 2 hết →Hiệu suất tính theo N 2 .
Đặt số mol N 2 ban đầu là x mol, n N 2 ban đầu = 4x mol;
Do hiệu suất phản ứng là 25% nên n N 2 pứ = 25%.x = 0,25x mol
Chia dung dịch gồm glucozơ và saccarozơ (có tỉ lệ mol 1 : 1) thành hai phần bằng nhau.
Cho phần một tác dụng với A g N O 3 dư (trong dung dịch N H 3 , t o ), thu được tối đa a mol A g . Thủy phân hoàn toàn phần hai (có xúc tác axit, t o ), thu được dung dịch G; thực hiện phản ứng tráng bạc hoàn toàn G, thu được b mol A g . Tỉ lệ a : b tương ứng là
A. 1 : 1
B. 2 : 3
C. 1 : 3
D. 1 : 2
Trong một bình kín dung tích V lít không đổi có chứa 1,3a mol O2 và 2,5a mol SO2 ở 100oC, 2 atm (có mặt xúc tác V2O5), nung nóng bình một thời gian sau đó làm nguội tới 100oC, áp suất trong bình lúc đó là p; hiệu suất phản ứng tương ứng là h. Mối liên hệ giữa p và h được biểu thị bằng biểu thức
A. p = 2. 1 - 1 , 25 h 3 , 8
B. p = 2. 1 - 2 , 5 h 3 , 8
C. p = 2. 1 - 0 , 65 h 3 , 8
D. p = 2. 1 - 1 , 3 h 3 , 8
Đáp án : A
Hỗn hợp đầu có : V = nhh đầu RT/Pđ
2SO2 + O2 2SO3
Bđ 2,5a 1,3a
Pứ 2,5ah 1,25ah 2,5ah
Sau2,5a(1-h) a(1,3 – 1,25h) 2,5ah
Sau phản ứng : nhh sau = 3,8 – 1,25ah
=> p = nhh sau . RT/V = nhh sau .Pđ/nđ = p = 2. 1 - 1 , 25 h 3 , 8
Thực hiện phản ứng giữa N2 và H2 (tỉ lệ mol 1:4) trng bình kín có xúc tác thu được hỗn hợp có áp suất giảm 20% so với ban đầu ( cùng điều kiện). Hiệu suất phản ứng là