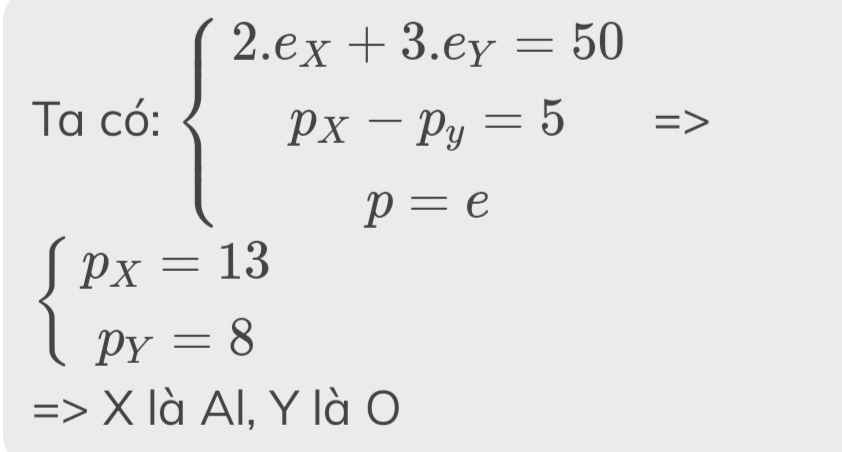cho hai nguyên tử của hai nguyên tố X,Y ở hai chu kỳ khác nhau có tổng số hiệu nguyên tử bằng 26. X thuộc nhóm VA.
a) Xác định số hiệu nguyên tử và tên hai nguyên tố X,Y.
b) Viết công thức phân tử hydroxit có hoá trị cao nhất của X,Y.
mọi người giúp e bài này với ạ