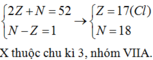Nguyên tử của X có số hạt mang điện trong hạt nhân là 19. Vị trí của X trong bảng tuần hoàn

Những câu hỏi liên quan
Nguyên tử của nguyên tố X có tổng số hạt mang điện trong hạt nhân là 13. Vị trí của X trong bảng tuần hoàn là
A. Chu kỳ 3, nhóm IIIA.
B. Chu kỳ 2, nhóm IIIA.
C. Chu kỳ 3, nhóm IIA.
D. Chu kỳ 3, nhóm VIIA.
nguyên tử của nguyên tố x có tổng số hạt nhân là 40. số hạt mang điện nhiều hơn hạt không mang điện là 12. xác định vị trí của nguyên tố x trong bảng tuần hoàn.
Số hạt mang điện là:(40 + 12): 2 = 26 hạt
Số hạt không mang điện là: 40 - 26 = 14 hạt
Nguyên tố x là Fe(sắt) vì trong bảng tuần hoàn hoá học điện tích hạt nhân của Fe = 26.
Đúng 5
Bình luận (0)
Nguyên tử của nguyên tố X có tổng số hạt proton, nơtron, electron là 52. Trong hạt nhân nguyên tử X có số hạt không mang điện nhiều hơn số hạt mang điện là 1. Vị trí (chu kì, nhóm) của X trong bảng tuần hoàn các nguyên tố hóa học là A. chu kì 3, nhóm VA B. chu kì 3, nhóm VIIA C. chu kì 2, nhóm VA D. chu kì 2, nhóm VIIA
Đọc tiếp
Nguyên tử của nguyên tố X có tổng số hạt proton, nơtron, electron là 52. Trong hạt nhân nguyên tử X có số hạt không mang điện nhiều hơn số hạt mang điện là 1. Vị trí (chu kì, nhóm) của X trong bảng tuần hoàn các nguyên tố hóa học là
A. chu kì 3, nhóm VA
B. chu kì 3, nhóm VIIA
C. chu kì 2, nhóm VA
D. chu kì 2, nhóm VIIA
Một ion
M
3
+
có tổng số hạt proton, nơtron, electron là 79, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 19. Vị trí của nguyên tử M trong bảng tuần hoàn là A. Chu kì 4, nhóm IIA B. Chu kì 4, nhóm VIIIB C. Chu kì 4, nhóm VIB D. Chu kì 4
Đọc tiếp
Một ion M 3 + có tổng số hạt proton, nơtron, electron là 79, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 19. Vị trí của nguyên tử M trong bảng tuần hoàn là
A. Chu kì 4, nhóm IIA
B. Chu kì 4, nhóm VIIIB
C. Chu kì 4, nhóm VIB
D. Chu kì 4
Một ion M3+ có tổng số hạt proton, nơtron, electron là 79, trong đó sốhạt mang điện nhiều hơn số hạt không mang điện là 19. Vị trí của nguyên tử M trong bảng tuần hoàn là A. Chu kì 4, nhóm IIA B. Chu kì 4, nhóm VIIIB C. Chu kì 4, nhóm VIB D. Chu kì 4, nhóm IIB
Đọc tiếp
Một ion M3+ có tổng số hạt proton, nơtron, electron là 79, trong đó sốhạt mang điện nhiều hơn số hạt không mang điện là 19. Vị trí của nguyên tử M trong bảng tuần hoàn là
A. Chu kì 4, nhóm IIA
B. Chu kì 4, nhóm VIIIB
C. Chu kì 4, nhóm VIB
D. Chu kì 4, nhóm IIB
Đáp án B
Giả sử số hiệu nguyên tử, số nơtron của M lần lượt là Z, N.
Ta có hpt: 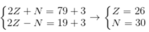
Cấu hình electron của M là 26M: 1s22s22p63s23p63d64s2.
M có số lớp = 4 → M thuộc chu kì 4.
M có 8 electron hóa trị, electron cuối cùng điền vào phân lớp 3d → M thuộc nhóm VIIIB.
→ Chọn B.
Đúng 0
Bình luận (0)
Cho các thông tin sau: Ion
X
2
-
có cấu trúc electron:
1
s
2
2
s
2
2
p
6
3
s
2
3
p
6
Nguyên tố Y có tổng số hạt cơ bản trong nguyên tử là 40. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là...
Đọc tiếp
Cho các thông tin sau:
Ion X 2 - có cấu trúc electron: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6
Nguyên tố Y có tổng số hạt cơ bản trong nguyên tử là 40. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12.
Ion Z 2 + có tổng số hạt mang điện tích dương trong hạt nhân bằng 29.
Vị trí của X, Y, Z trong bảng tuần hoàn lần lượt là:
A. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 29, chu kì 4, nhóm IB).
B. (X: ô 16, chu kỳ 3, nhóm VIA); (Y: ô 13, chu kì 3, nhóm IA); (Z: ô 29, chu kì 4, nhóm IIB).
C. (X: ô 20, chu kỳ 4, nhóm IIA); (Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 29, chu kì 4, nhóm IB).
D. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 31, chu kì 4, nhóm IIIA).
nguyên tử của nguyên tố X có tổng số hạt p,n,e là 52, trong đó tổng số hạt mang điện nhiều gấp 1,889 lần số hạt không mang điện. Viết cấu hình electron nguyên tử của nguyên tố X, xác định vị trí của X trong bảng tuần hoàn và gọi tên X
gọi số prton,electron và notron của X lần lượt là :p,e,n
do p=e=> p+e=2p
theo đề ta có hpt: \(\begin{cases}2p+n=52\\2p=1,889n\end{cases}\)
<=> \(\begin{cases}p=17\\n=18\end{cases}\)
do p=17
=> x là Clo (Cl)
Cl nằm ở ô thứ 17 trong BTH
Đúng 0
Bình luận (2)
Câu 6: Trong nguyên tử nguyên tố A có tổng số các loại hạt là 58. Biết trong hạt nhân, số hạt mang điện ít hơn số hạt không mang điện là 1 hạt.a. Viết kí hiệu nguyên tử nguyên tố A.b. Xác định vị trí của nguyên tố A trong bảng tuần hoàn. Giải thích?GIÚP EM Ý B VỚI Ạ,NHANH NHÉ VÌ EM ĐANG CẦN RẤC GẤP
Đọc tiếp
Câu 6: Trong nguyên tử nguyên tố A có tổng số các loại hạt là 58. Biết trong hạt nhân, số hạt mang điện ít hơn số hạt không mang điện là 1 hạt.
a. Viết kí hiệu nguyên tử nguyên tố A.
b. Xác định vị trí của nguyên tố A trong bảng tuần hoàn. Giải thích?
GIÚP EM Ý B VỚI Ạ,NHANH NHÉ VÌ EM ĐANG CẦN RẤC GẤP
Cho các thông tin sau: Ion X2- có cấu trúc electron: 1s22s22p63s23p6. Nguyến tố Y có tổng số hạt cơ bản trong nguyên tử là 40. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12. Ion Z2+ có tổng số hạt mang điện tích dương trong hạt nhân bằng 29. Vị trí của X, Y, Z trong bảng tuần hoàn lần lượt là: A. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 29, chu kì 4, nhóm IB). B. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IA); (Z: ô 29, chu kì 4, nhó...
Đọc tiếp
Cho các thông tin sau:
Ion X2- có cấu trúc electron: 1s22s22p63s23p6.
Nguyến tố Y có tổng số hạt cơ bản trong nguyên tử là 40. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12.
Ion Z2+ có tổng số hạt mang điện tích dương trong hạt nhân bằng 29.
Vị trí của X, Y, Z trong bảng tuần hoàn lần lượt là:
A. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 29, chu kì 4, nhóm IB).
B. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IA); (Z: ô 29, chu kì 4, nhóm IIB).
C. (X: ô 20, chu kỳ 4, nhóm IIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 29, chu kì 4, nhóm IB).
D. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 31, chu kì 4, nhóm IIIA).
Đáp án A
Ion X2- có cấu trúc electron: 1s22s22p63s23p6
X + 2e → X2-
Vậy cấu hình electron của X là 1s22s22p63s23p4
X có 3 lớp electron → X thuộc chu kì 3.
X có số electron = 16 → X thuộc ô 16.
X có 6 electron hóa trị, electron cuối cùng điền vào phân lớp 3p → X thuộc nhóm VIA.
• Nguyên tố Y có tổng số hạt cơ bản trong nguyên tử là 40. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12.
Giả sử số hiệu nguyên tử, số nơtron của Y lần lượt là Z, N
Ta có hpt: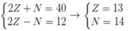
Cấu hình electron của Y là 13Y: 1s22s22p63s23p1
Y có 3 lớp electron → X thuộc chu kì 3.
Y có số electron = 13 → X thuộc ô số 13.
Y có 3 electron hóa trị, electron cuối cùng điền vào phân lớp 3p → Y thuộc nhóm IIIA.
• Ion Z2+ có tổng số hạt mang điện tích dương trong hạt nhân bằng 29.
Z có số hạt mang điện tích dương bằng ion Z2+
Cấu hình electron của Z là 29Z: 1s22s22p63s23p63d104s1
Z thuộc ô số 29.
Z có 4 lớp electron → X thuộc chu kì 4.
Z có electron cuối cùng điền vào phân lớp 3d, có 1 electron hóa trị → Z thuộc nhóm IB.
→ Chọn A.
Đúng 0
Bình luận (0)
a) Trong ion X3- có tổng số các hạt (p,e,n) là 49, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 17. Xác định số khối, viết cấu hình electron của nguyên tử X và cho biết vị trí của X trong bảng tuần hoàn các nguyên tố hoá học. b) Trong tự nhiên Flo có 2 dồng vị: 18F chiếm 0,2%, xác định số khối của đồng vị thứ 2, biết rằng Flo có nguyên tử khối trung bình là 18,998u