Hòa tan 20,88 gam một oxit sắt bằng H2SO4 đặc , nóng dư thu được 3,248 lít SO2 ( ở đktc ) . Tìm công thức cho FeO .
Hòa tan hoàn toàn 20,88 gam một oxit sắt bằng dung dịch axit H2SO4 đặc, nóng thu được dung dịch X và 3,248 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là
A. 52,2.
B. 48,4.
C. 58,0.
D. 54,0.
Đáp án C
Quy đổi oxit sắt thành hỗn hợp của Fe và O.
Vì chất rắn ban đầu đem hòa tan trong dung dịch H2SO4 đặc nóng là oxit sắt nên số oxi hóa của sắt trong hợp chất ban đầu nhỏ nhất là +2. Mặt khác, phản ứng tạo thành SO2 nên đây là phản ứng oxi hóa - khử. Do đó số oxi hóa của sắt tăng lên trong hợp chất cuối cùng thành +3.

Hòa tan hoàn toàn 20,88 gam một oxit sắt bằng dung dịch H2SO4 đặc, nóng thu được dung dịch X và 3,248 lít khí SO2 ( sản phẩm khử duy nhất, ở đktc). Cô cạn dung dịch X, thu được m gam muối sunfat khan. Giá trị của m là
A. 58,0
B. 54,0.
C. 52,2.
D. 48,4.
Hòa tan hoàn toàn 20,88 gam một oxit sắt bằng dung dịch H2SO4 đặc, nóng thu được dung dịch X và 3,248 lít khí SO2 ( sản phẩm khử duy nhất, ở đktc). Cô cạn dung dịch X, thu được m gam muối sunfat khan. Giá trị của m là
A. 58,0.
B. 54,0.
C. 52,2.
D. 48,4.
Hòa tan hoàn toàn 20,88 gam một oxit sắt bằng dung dịch H2SO4 đặc, nóng thu được dung dịch X và 3,248 lít khí SO2 ( sản phẩm khử duy nhất, ở đktc). Cô cạn dung dịch X, thu được m gam muối sunfat khan. Giá trị của m là
A. 58,0.
B. 54,0.
C. 52,2.
D. 48,4.
Coi oxit sắt là Fe và O có số mol lần lượt là x và y (mol)
nSO2 = 0,145 (mol)
Qúa trình nhường e
Fe -3e → Fe3+
x 3x (mol)
Quá trình nhận e
O + 2e → O-2
y 2y (mol)
S +6 +2e → SO2
0,29 ← 0,145 (mol)
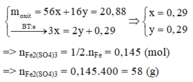
Đáp án A
Hòa tan hoàn toàn 20,88 gam một oxit sắt bằng dung dịch H2SO4 đặc, nóng thu được dung dịch X và 3,248 lít khí SO2 (sản phẩm khử duy nhất, đktc). Cô cạn dung dịch X thu được m gam muối sunfat khan. Giá trị của m là
A. 58,0.
B. 48,4
C. 52,2.
D. 54,0.
Đáp án A
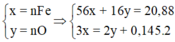
![]()
=> mFe2(SO4)3 = 0,145.400 = 58g => Chọn A.
Hòa tan hoàn toàn 20,88 gam một oxit sắt bằng dung dịch H2SO4 đặc, nóng thu được dung dịch X và 3,248 lít khí SO2 (sản phẩm khử duy nhất, đktc). Cô cạn dung dịch X thu được m gam muối sunfat khan. Giá trị của m là
A. 58,0.
B. 48,4.
C. 52,2.
D. 54,0.
Đáp án A
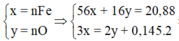
![]()
=> mFe2(SO4)3 = 0,145.400 = 58g => Chọn A.
Hòa tan hoàn toàn 20,88 gam một oxit sắt bằng dung dịch H2SO4 đặc, nóng thu được dung dịch X và 3,248 lít khí SO2 (sản phẩm khử duy nhất, đktc). Cô cạn dung dịch X thu được m gam muối sunfat khan. Giá trị của m là
A. 58,0.
B. 48,4.
C. 52,2
D. 54,0
Hoà tan hoàn toàn 20,88 g 1 oxit FexOy bằng dung dịch H2SO4 đặc, nóng, dư thu được dung dịch X và 3,248 lít khí SO2( sản phẩm khử duy nhất, đktc). Xác định công thức phân tử của FexOy và tính khối lượng muối trung hòa có trong X.
Coi oxit gồm $Fe(x\ mol) ; O(y\ mol)$
Ta có : 56x + 16y = 20,88(1)$
$n_{SO_2} = 0,145(mol)$
Bảo toàn electron : $3x = 2y + 0,145.2(2)$
Từ (1)(2) suy ra x = 0,29 ; y = 0,29$
$n_{Fe} : n_O = 0,29 : 0,29 = 1 : 1$
Do đó, oxit là $FeO$
$n_{Fe_2(SO_4)_3} = \dfrac{1}{2}n_{Fe} = 0,145(mol)$
$m_{Fe_2(SO_4)_3} = 0,145.400 = 58(gam)$
Có hỗn hợp X gồm Al và một oxit sắt. Nung nóng hỗn hợp X trong điều kiện không có không khí đến khi phản ứng xảy ra hoàn toàn thu được 96,6 gam chất rắn Y. Hòa tan 96,6 gam chất rắn Y trong NaOH dư, thu được 6,72 lít khí (đktc). Nếu hòa tan 96,6 gam chất rắn Y trong dung dịch H2SO4 đặc nóng thu được 36,96 lít khí SO2 (đktc). Công thức oxit sắt là
A. Fe2O3
B. FeO
C. Fe3O4
D. FeO hoặc Fe3O4