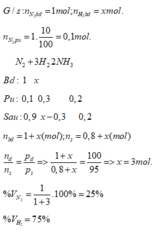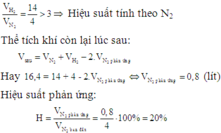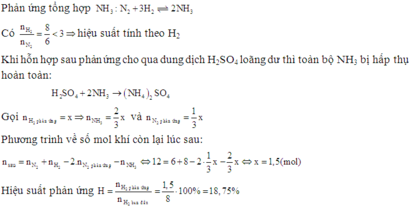: Thực hiện phản ứng giữa H2 và N2 (tỉ lệ mol 4:1), trong bình kín có xúc tác, thu được hỗn hợp khí có áp suất giảm 9% so với ban đầu ( trong cùng điều kiện). Tính Hiệu suất phản ứng.

Những câu hỏi liên quan
Thực hiện phản ứng giữa H 2 và N 2 (tỉ lệ mol 4 : 1) trong bình kín có xúc tác, thu được hỗn hợp khi có áp suất giảm 9% so với ban đầu (trong cùng điều kiện). Hiệu suất phản ứng là
A. 20%
B. 22,5%.
C. 25%.
D. 27%.
Thực hiện phản ứng giữa
H
2
v
à
N
2
(tỉ lệ mol 4 : 1) trong bình kín có xúc tác, thu được hỗn hợp khi có áp suất giảm 9% so với ban đầu (trong cùng điều kiện). HIệu suất phản ứng là A. 20%. B. 22,5%. C. 25%. D. 27%.
Đọc tiếp
Thực hiện phản ứng giữa H 2 v à N 2 (tỉ lệ mol 4 : 1) trong bình kín có xúc tác, thu được hỗn hợp khi có áp suất giảm 9% so với ban đầu (trong cùng điều kiện). HIệu suất phản ứng là
A. 20%.
B. 22,5%.
C. 25%.
D. 27%.
Chọn B
nH2 = 4 mol; nN2 = 1 mol
Hỗn hợp khí có áp suất giảm 9%
→ Số mol sau phản ứng = 91%.5 = 4,55 mol
3H2 + N2 ⇆ 2NH3 do số mol H2 : N2 = 4 : 1 nên hiệu suất tính theo N2
Pư: 3x x 2x
n hỗn hợp sau pư = n H2 dư + n N2 dư + n NH3 = 4 -3x + 1 – x + 2x = 5 -2x = 4,55
ð x = 0,225 => H% = 22,5%
Đúng 0
Bình luận (0)
Thực hiện phản ứng giữa N2 và H2 (tỉ lệ mol 1:4) trong bính kín có xúc tác, thu được hỗn hợp có áp suất giảm 10% so với ban đầu (cùng đk). Hiệu suất phản ứng là A. 25% B. 50% C. 75% D. 60%
Đọc tiếp
Thực hiện phản ứng giữa N2 và H2 (tỉ lệ mol 1:4) trong bính kín có xúc tác, thu được hỗn hợp có áp suất giảm 10% so với ban đầu (cùng đk). Hiệu suất phản ứng là
A. 25%
B. 50%
C. 75%
D. 60%
Một hỗn hợp N2 và H2 được lấy vào bình phản ứng có nhiệt độ được giữ không đổi. Sau một thời gian phản ứng, áp suất của các khí trong bình giảm 10% so với áp suất ban đầu. Biết rằng tỉ lệ số mol N2 đã phản ứng là 10%. Tính thành phần phần trăm số mol N2 trong hỗn hợp đầu? A. 50% B. 49% C. 47% D. 48%
Đọc tiếp
Một hỗn hợp N2 và H2 được lấy vào bình phản ứng có nhiệt độ được giữ không đổi. Sau một thời gian phản ứng, áp suất của các khí trong bình giảm 10% so với áp suất ban đầu. Biết rằng tỉ lệ số mol N2 đã phản ứng là 10%. Tính thành phần phần trăm số mol N2 trong hỗn hợp đầu?
A. 50%
B. 49%
C. 47%
D. 48%
Cho hỗn hợp N2 và H2 vào bình phản ứng có nhiệt độ không đổi. Sau một thời gian phản ứng, áp suất khí trong bình giảm 5% so với áp suất ban đầu. Biết tỉ lệ số mol của nitơ đã phản ứng là 10%. Thành phần phần trăm về số mol của N2 và H2 trong hỗn hợp đầu là: A. 15% và 85% B. 82,35% và 77,5% C. 25% và 75% D. 22,5% và 77,5%
Đọc tiếp
Cho hỗn hợp N2 và H2 vào bình phản ứng có nhiệt độ không đổi. Sau một thời gian phản ứng, áp suất khí trong bình giảm 5% so với áp suất ban đầu. Biết tỉ lệ số mol của nitơ đã phản ứng là 10%. Thành phần phần trăm về số mol của N2 và H2 trong hỗn hợp đầu là:
A. 15% và 85%
B. 82,35% và 77,5%
C. 25% và 75%
D. 22,5% và 77,5%
Đáp án C
Giả sử có 1 mol hỗn hợp đầu. Gọi x và y (mol) lần lượt là số mol của N₂ và H₂ trong 1 mol hỗn hợp đầu
Gọi n₁, P₁ và n₂, P₂ lần lượt là số mol hỗn hợp khí + áp suất trong bình ban đầu và lúc sau
⇒ n₁ = x + y = 1 (1)
Khi nhiệt độ không đổi
⇒ n₁ / n₂ = P₁ / P₂
Áp suất khí trong bình giảm 5% so với áp suất ban đầu ⇒ P₁ / P₂ = 20 / 19
⇒ n₁ / n₂ = 20 / 19 (2)
Số mol của nito đã phản ứng là 10% ⇒ N₂ pứ 0,1x mol
N₂ + 3H₂ → 2NH₃
Trước: x y 0
Pứ 0,1x 0,3x 0,2x
Sau: n N₂ = 0,9x ; n H₂ = y - 0,3x ; n NH₃ = 0,2x
⇒ n₂ = 0,9x + y - 0,3x + 0,2x
⇒ n₂ = 0,8x + y (3)
Từ (1) (2) & (3) ta có:
(x + y) / (0,8x + y) = 20 / 19
⇒ 3x - y = 0 (4)
Giải hệ (1) & (4) cho ta: x = 0,25 mol và y = 0,75 mol
Thành phần phần trăm về số mol của N₂ và H₂ trong hỗn hợp đầu là:
%N₂ = 25% và %H₂ = 75%
Đúng 0
Bình luận (0)
Cho hỗn hợp N2 và H2 vào bình phản ứng có nhiệt độ không đổi. Sau một thời gian phản ứng, áp suất khí trong bình giảm 5% so với áp suất ban đầu. Biết tỉ lệ số mol của nitơ đã phản ứng là 10%. Thành phần phần trăm về số mol của N2 và H2 trong hỗn hợp đầu là: A. 15% và 85% B. 82,35% và 77,5% C. 25% và 75% D. 22,5% và 77,5%.
Đọc tiếp
Cho hỗn hợp N2 và H2 vào bình phản ứng có nhiệt độ không đổi. Sau một thời gian phản ứng, áp suất khí trong bình giảm 5% so với áp suất ban đầu. Biết tỉ lệ số mol của nitơ đã phản ứng là 10%. Thành phần phần trăm về số mol của N2 và H2 trong hỗn hợp đầu là:
A. 15% và 85%
B. 82,35% và 77,5%
C. 25% và 75%
D. 22,5% và 77,5%.
Cho 4 lít khí N2 và 14 lít khí H2 trong bình phản ứng ở nhiệt độ khoảng 4000C, xúc tác. Sau phản ứng thu được 16,4 lít hỗn hợp khí ở cùng điều kiện nhiệt độ, áp suất. Tính hiệu suất của phản ứng? A. 20% B. 80% C. 25% D. 60%
Đọc tiếp
Cho 4 lít khí N2 và 14 lít khí H2 trong bình phản ứng ở nhiệt độ khoảng 4000C, xúc tác. Sau phản ứng thu được 16,4 lít hỗn hợp khí ở cùng điều kiện nhiệt độ, áp suất. Tính hiệu suất của phản ứng?
A. 20%
B. 80%
C. 25%
D. 60%
Hỗn hợp X gồm N2 và H2 có tỉ khối đối với H2 bằng 3,6. Nung nóng X trong bình kín ở nhiệt độ khoảng 450°C có bột Fe làm xúc tác, thu được hỗn hợp khí Y có số mol giảm 8% so với ban đầu. Hiệu suất phản ứng tổng hợp NH3 là
A. 25%.
C. 16%.
B. 23%.
D. 20%.
Thực hiện phản ứng giữa 8 mol H2 và 6 mol N2 với bột sắt làm xúc tác. Hỗn hợp sau phản ứng cho qua dung dịch H2SO4 loãng dư còn lại 12 mol khí. Tính hiệu suất phản ứng. (Thể tích các khí đo ở cùng điều kiện nhiệt độ và áp suất) A. 24%. B. 36% C. 18,75% D. 35,5%
Đọc tiếp
Thực hiện phản ứng giữa 8 mol H2 và 6 mol N2 với bột sắt làm xúc tác. Hỗn hợp sau phản ứng cho qua dung dịch H2SO4 loãng dư còn lại 12 mol khí. Tính hiệu suất phản ứng. (Thể tích các khí đo ở cùng điều kiện nhiệt độ và áp suất)
A. 24%.
B. 36%
C. 18,75%
D. 35,5%





 A.
A.