cho một đinh sắt nặng 90 gam được nhúng vào dung dịch đồng sunfat . sau một thời gian lấy đinh sắt ra cân được 91,3 kg hỏi thanh sắt còn lại có bao nhiêu khối lượng sắt và cu

Những câu hỏi liên quan
Nhúng một đinh sắt sạch vào dung dịch Cu(NO3)2. Sau một thời gian lấy đinh sắt ra, làm khô, thấy khối lượng đinh sắt tăng 1 gam. Khối lượng sắt đã phản ứng là:A. 2,8 gam. A. 2,8 gam. B. 7,0 gam. C. 3,5 gam. D. 5,6 gam.
Đọc tiếp
Nhúng một đinh sắt sạch vào dung dịch Cu(NO3)2. Sau một thời gian lấy đinh sắt ra, làm khô, thấy khối lượng đinh sắt tăng 1 gam. Khối lượng sắt đã phản ứng là:A. 2,8 gam.
A. 2,8 gam.
B. 7,0 gam.
C. 3,5 gam.
D. 5,6 gam.
Đáp án B
Ta có phản ứng: Fe + Cu2+ → Fe2+ + Cu↓
+ Đặt nFe pứ = a mol ⇒ nCu tạo thành = a mol.
⇒ mCu – mFe = 64a – 56a = 8a = 1 gam.
Û a = 0,125 ⇒ mFe đã pứ = 0,125×56 = 7 gam
Đúng 0
Bình luận (0)
Nhúng một đinh sắt sạch vào dung dịch Cu(NO3)2. Sau một thời gian lấy đinh sắt ra, làm khô, thấy khối lượng đinh sắt tăng 1 gam. Khối lượng sắt đã phản ứng là A. 2,8 gam. B. 7,0 gam. C. 3,5 gam. D. 5,6 gam.
Đọc tiếp
Nhúng một đinh sắt sạch vào dung dịch Cu(NO3)2. Sau một thời gian lấy đinh sắt ra, làm khô, thấy khối lượng đinh sắt tăng 1 gam. Khối lượng sắt đã phản ứng là
A. 2,8 gam.
B. 7,0 gam.
C. 3,5 gam.
D. 5,6 gam.
Ta có phản ứng: Fe + Cu2+ → Fe2+ + Cu↓
+ Đặt nFe pứ = a mol ⇒ nCu tạo thành = a mol.
⇒ mCu – mFe = 64a – 56a = 8a = 1 gam.
→ a = 0,125 ⇒ mFe đã pứ = 0,125×56 = 7 gam.
Đáp án B
Đúng 0
Bình luận (0)
Nhúng một đinh sắt sạch vào dung dịch Cu(NO3)2. Sau một thời gian lấy đinh sắt ra, làm khô, thấy khối lượng đinh sắt tăng 1 gam. Khối lượng sắt đã phản ứng là A. 3,5 gam B. 7,0 gam C. 5,6 gam D. 2,8 gam
Đọc tiếp
Nhúng một đinh sắt sạch vào dung dịch Cu(NO3)2. Sau một thời gian lấy đinh sắt ra, làm khô, thấy khối lượng đinh sắt tăng 1 gam. Khối lượng sắt đã phản ứng là
A. 3,5 gam
B. 7,0 gam
C. 5,6 gam
D. 2,8 gam
Đáp án : B
Fe + Cu2+ -> Fe2+ + Cu
x -> x
mtăng = 64x – 56x = 1g => x = 0,125 mol
=> mFe pứ = 7g
Đúng 0
Bình luận (0)
Nhúng một đinh sắt sạch vào dung dịch Cu(NO3)2. Sau một thời gian lấy đinh sắt ra, làm khô, thấy khối lượng đinh sắt tăng 1 gam. Khối lượng sắt đã phản ứng là:
A. 3,5 gam.
B. 2,8 gam.
C. 7,0 gam.
D. 5,6 gam.
Nhúng một đinh sắt sạch vào dung dịch Cu(NO3)2. Sau một thời gian lấy đinh sắt ra, làm khô, thấy khối lượng đinh sắt tăng 1 gam. Khối lượng sắt đã phản ứng là
A. 3,5 gam
B. 2,8 gam
C. 7,0 gam
D. 5,6 gam
Đáp án C
Fe + Cu2+ -> Fe2+ + Cu
.x -> x mol
=> mtăng = 64x – 56x = 1g => x = 0,125 mol
=> mFe pứ = 7g
Đúng 0
Bình luận (0)
Nhúng một thanh sắt vào dung dịch C u S O 4 sau một thời gian lấy thanh sắt ra khổi dung dịch cân lại thấy nặng thêm 0,8g. Khối lượng dung dịch giảm so với ban đầu là bao nhiêu gam (Cu=64, Fe=56)?
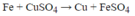
Theo phương trình cứ 56 gam Fe tan vào dung dịch thì có 64 gam Cu tách ra khỏi dung dịch. Thanh Fe tăng khối lượng nên khối lượng dung dịch phải giảm đi đúng bằng khối lượng thanh Fe tăng lên.
Vậy khối lượng thanh sắt tăng 0,8 gam khối lượng dung dịch giảm so với ban đầu 0,8 gam
Đúng 0
Bình luận (0)
Nhúng một thanh sắt có khối lượng 15,6 gam vào dung dịch CuSO4 sau một thời gian lấy đinh sắt ra khỏi dung dịch thấy khối lượng thanh sắt là 16,4 gam tính khối lượng sắt tham gia phản ứng biết rằng tất cả đồng sinh ra đều bám lên bề mặt của sắt
Fe + CuSO4 = FeSO4 + Cu
Sau phản ứng khối lượng thanh sắt tăng lên, chứng tỏ có 1 lượng Cu bám lên thanh sắt.
Khối lượng Cu phản ứng là: 16,4 - 15,6 = 0,8 (g)
Số mol Cu là: 0,8 : 64 = 0,0125 (mol)
Theo PTHH: n Fe= nCu = 0,0125 (mol)
Khối lượng sắt tham gia phản ứng là: 0,0125 x 56 = 0,7(g)
Đúng 0
Bình luận (0)
Trong giờ thực hành hóa học, một học sinh nhúng một đinh sắt vào dung dịch muối đồng sunfat
C
u
S
O
4
. Sau một thời gian, lấy đinh sắt ra khỏi dung dịch muối. Thanh sắt bị phủ một lớp màu đỏ gạch và dung dịch có muối sắt (II) sunfat
F
e
S
O
4
. Hãy viết phương trình phản ứng.
Đọc tiếp
Trong giờ thực hành hóa học, một học sinh nhúng một đinh sắt vào dung dịch muối đồng sunfat C u S O 4 . Sau một thời gian, lấy đinh sắt ra khỏi dung dịch muối. Thanh sắt bị phủ một lớp màu đỏ gạch và dung dịch có muối sắt (II) sunfat F e S O 4 . Hãy viết phương trình phản ứng.
Trong giờ thực hành hóa học, một học sinh nhúng một đinh sắt vào dung dịch muối đồng sunfat
C
u
S
O
4
. Sau một thời gian, lấy đinh sắt ra khỏi dung dịch muối. Thanh sắt bị phủ một lớp màu đỏ gạch và dung dịch có muối sắt (II) sunfat
F
e
S
O
4
. Hãy cho biết phản ứng trên thuộc loại phản ứng nào?
Đọc tiếp
Trong giờ thực hành hóa học, một học sinh nhúng một đinh sắt vào dung dịch muối đồng sunfat C u S O 4 . Sau một thời gian, lấy đinh sắt ra khỏi dung dịch muối. Thanh sắt bị phủ một lớp màu đỏ gạch và dung dịch có muối sắt (II) sunfat F e S O 4 . Hãy cho biết phản ứng trên thuộc loại phản ứng nào?





