Cho Ag Fe và Bg dung dịch chứa Axit clohidric .Tìm khối lượng sao phản ứng

Những câu hỏi liên quan
Bài 2 Cho 12g Fe và 10g dung dịch chứa Axit clohidric .Tìm khối lượng sao phản ứng
Cho 0,02 mol Fe vào dung dịch chứa 0,045 mol AgNO3. Khi phản ứng xảy ra hoàn toàn thì khối lượng Ag thu được là:
A. 4,32
B. 2,16
C. 1,08
D. 4,86
Đáp án D
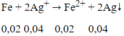
⇒ nAg+ dư = 0,045 - 0,04 = 0,005 mol. Khi đó xảy ra phản ứng:
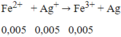
⇒ mAg = (0,04 + 0,005).108 = 4,86g
Đúng 0
Bình luận (0)
Cho dung dịch chứa 3,51 gam hỗn hợp gồm saccarozơ và glucozơ phản ứng AgNO3 dư trong dung dịch NH3 thu được 2,16 gam Ag. Vậy phần trăm theo khối lượng saccarozơ trong hỗn hợp ban đầu là: A. 48,72% B. 48,24% C. 51,23% D. 55,23%
Đọc tiếp
Cho dung dịch chứa 3,51 gam hỗn hợp gồm saccarozơ và glucozơ phản ứng AgNO3 dư trong dung dịch NH3 thu được 2,16 gam Ag. Vậy phần trăm theo khối lượng saccarozơ trong hỗn hợp ban đầu là:
A. 48,72%
B. 48,24%
C. 51,23%
D. 55,23%
Đáp án A
Hướng dẫn:
Sơ đồ phản ứng
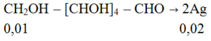
Vậy:
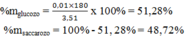
Đúng 0
Bình luận (0)
Cho dung dịch chứa 3,51 gam hỗn hợp gồm saccarozơ và glucozơ phản ứng AgNO3 dư trong dung dịch NH3 thu được 2,16 gam Ag. Vậy phần trăm theo khối lượng saccarozơ trong hỗn hợp ban đầu là: A. 48,72% B. 48,24% C. 51,23% D. 55,23%
Đọc tiếp
Cho dung dịch chứa 3,51 gam hỗn hợp gồm saccarozơ và glucozơ phản ứng AgNO3 dư trong dung dịch NH3 thu được 2,16 gam Ag. Vậy phần trăm theo khối lượng saccarozơ trong hỗn hợp ban đầu là:
A. 48,72%
B. 48,24%
C. 51,23%
D. 55,23%
Cho 2,7 gam hỗn hợp bột X gồm Fe và Zn tác dụng với dung dịch CuSO4. Sau một thời gian, thu được dung dịch Y và 2,84 gam chất rắn Z. Cho toàn bộ Z vào dung dịch H2SO4 (loãng, dư). Sau khi các phản ứng kết thúc thì khối lượng chất rắn giảm 0,28 gam và dung dịch thu được chỉ chứa một muối duy nhất. Phần trăm khối lượng của Fe trong X là: A. 58,52% B. 51,85% C. 48,15% D. 41,48%
Đọc tiếp
Cho 2,7 gam hỗn hợp bột X gồm Fe và Zn tác dụng với dung dịch CuSO4. Sau một thời gian, thu được dung dịch Y và 2,84 gam chất rắn Z. Cho toàn bộ Z vào dung dịch H2SO4 (loãng, dư). Sau khi các phản ứng kết thúc thì khối lượng chất rắn giảm 0,28 gam và dung dịch thu được chỉ chứa một muối duy nhất. Phần trăm khối lượng của Fe trong X là:
A. 58,52%
B. 51,85%
C. 48,15%
D. 41,48%
Đáp án B
Zn có tính khử mạnh hơn Fe, Zn sẽ phản ứng với dung dịch CuSO4 trước.
Theo đề: hỗn hợp rắn Z phản ứng với dung dịch H2SO4 loãng thu được 1 muối duy nhất → trong hỗn hợp rắn Z có Cu và Fe dư. Vậy mFe dư = 0,28 (g) và mCu = 2,84 - 0,28 = 2,56 (g)
Ta có: khối lượng hỗn hợp X phản ứng với Cu2+ = 2,7 - 0,28 = 2,42 (g)
Gọi nZn = x mol; nFe pư = y mol
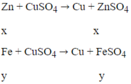
Ta có hệ:
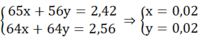
mFe ban đầu = 0,02.56 + 0,28 = 1,4 (g)
![]()
Đúng 0
Bình luận (0)
Hỗn hợp X gồm Cu và Fe có tỉ lệ khối lượng tương ứng là 7 : 3. Lấy m gam X phản ứng hoàn toàn với dung dịch chứa 0,7 mol HNO3. Sau phản ứng còn lại 0,75m gam chất rắn và có 0,25 mol khí Y gồm NO và NO2. Giá trị của m là:
A. 40,5
B. 50,4
C. 50,2
D. 50
Đáp án B
Ta có:
![]()
mCu = 0,7m (g)
Vì Fe phản ứng trước Cu và sau khi phản ứng còn 0,75m (g) chất rắn → Cu chưa phản ứng 0,7m
Fe dư 0,75m - 0,7m = 0,05m → mFe pư = 0,2m - 0,05m = 0,25m (g)
Fe dư → Chỉ tạo muối Fe(NO3)2
HNO3 hết (Lưu ý chỉ H+ hết, NO3- còn trong muối).
Quá trình nhường electron:

Quá trình nhận electron:
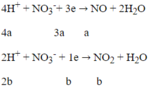
Áp dụng định luật bảo toàn electron:
![]()
→ m = 50,4
Đúng 0
Bình luận (0)
Cho 1 lượng bột Al phản ứng vừa đủ với dung dịch có chứa 44,1g H2so4 ,thu được muối Al2(so4)3 Và Khí H2.
A)tính Khối Lượng Al Phản Ứng
B)tính Thể Tích Khí H2( ở Đktc)
C)tính Khối Lượng AL2(So4)3 Theo 2 Cách
a) $n_{H_2SO_4} = \dfrac{44,1}{98} = 0,45(mol)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
Theo PTHH :
$n_{Al} = \dfrac{2}{3}n_{H_2SO_4} = 0,3(mol)$
$m_{Al} = 0,3.27 = 8,1(gam)$
b) $n_{H_2} = n_{H_2SO_4} = 0,45(mol)$
$\Rightarrow V_{H_2} = 0,45.22,4 =1 0,08(lít)$
c)
Cách 1 : $n_{Al_2(SO_4)_3} = \dfrac{1}{3}n_{H_2SO_4} = 0,15(mol)$
$\Rightarrow m_{Al_2(SO_4)_3} = 0,15.342 = 51,3(gam)$
Cách 2 : Bảo toàn khối lượng, $m_{Al_2(SO_4)_3} = 8,1 + 44,1 - 0,45.2 = 51,3(gam)$
Đúng 2
Bình luận (0)
Hòa tan kim loại Fe vào dung dịch HCL 20%.Phản ứng vừa đủ thu được 14,874 lit Hydrogen(đktc) 25°C , 1 bar.Tính khối lượng kim loại Fe phản ứng ? a.Tính khối lượng dung dịch HCL 20% phản ứng ? b. Tính nồng độ % dung dịch sau phản ứng? c.Tính số ml dd Ca(OH)2 3M cần để trung hòa lượng acid HCl trên
Hòa tan kim loại Fe vào dung dịch HCL 20%.Phản ứng vừa đủ thu được 14,874 lit Hydrogen(đktc) 25°C , 1 bar.Tính khối lượng kim loại Fe phản ứng ?
a.Tính khối lượng dung dịch HCL 20% phản ứng ?
b. Tính nồng độ % dung dịch sau phản ứng?
c.Tính số ml dd Ca(OH)2 3M cần để trung hòa lượng acid HCl trên
giúp mình vs ạ









