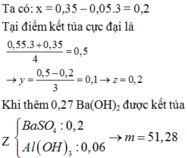MUỐN LÀM KẾT TỦA HOÀN TOÀN ION AL3+ TÁC DỤNG VỚI DUNG DỊCH NH3 . VIẾT SƠ ĐỒ CÔNG THỨC

Những câu hỏi liên quan
Dung dịch X được tạo ra từ 2 muối gồm có các ion: Al3+, Fe2+, SO42-, Cl- . Chia dung dịch X làm 2 phần bằng nhau. Phần 1 đem tác dụng vói dung dịch Ba(OH)2 dư, thu được 6,46 gam kết tủa. Phần 2 đem tác dụng với dung dịch NH3 dư, thu lấy kết tủa nung trong không khí đến khối lượng không đổi còn lại 2,11 gam chất rắn. Biết các phản ứng đều xảy ra hoàn toàn. Khối lượng muối trong dung dịch X gần nhất có thể là A. 17,5 g. B. 5,96 g. C. 3,475 g. D. 8,75 g.
Đọc tiếp
Dung dịch X được tạo ra từ 2 muối gồm có các ion: Al3+, Fe2+, SO42-, Cl- . Chia dung dịch X làm 2 phần bằng nhau. Phần 1 đem tác dụng vói dung dịch Ba(OH)2 dư, thu được 6,46 gam kết tủa. Phần 2 đem tác dụng với dung dịch NH3 dư, thu lấy kết tủa nung trong không khí đến khối lượng không đổi còn lại 2,11 gam chất rắn. Biết các phản ứng đều xảy ra hoàn toàn. Khối lượng muối trong dung dịch X gần nhất có thể là
A. 17,5 g.
B. 5,96 g.
C. 3,475 g.
D. 8,75 g.
Gọi x, y, z lần lượt là số mol Al3+ , Fe2+, SO42- trong dung dịch X. Ta có: nCl- = 3x + 2y - 2z (bảo toàn điện tích)
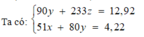
m = 162,5x + 127y + 25z
⇒ 7,58 <m< 14,83
Đáp án D
Đúng 0
Bình luận (0)
Dung dịch X được tạo ra từ 2 muối gồm có các ion Al3+, Fe2+,
S
O
4
2
-
, Cl-. Chia dung dịch X làm 2 phần bằng nhau. Phần 1 đem tác dụng với dung dịch Ba(OH)2 dư thu được 6,46 gam kết tủa. Phần 2 đem tác dung với dung dich NH3 dư thu lấy kết tủa nung trong không khí đến khối lượng không đổi còn lại 2,11 gam chất rắn. Biết các phản ứng đều xảy ra hoàn toàn. Khối lượng muối trong X có...
Đọc tiếp
Dung dịch X được tạo ra từ 2 muối gồm có các ion Al3+, Fe2+, S O 4 2 - , Cl-. Chia dung dịch X làm 2 phần bằng nhau. Phần 1 đem tác dụng với dung dịch Ba(OH)2 dư thu được 6,46 gam kết tủa. Phần 2 đem tác dung với dung dich NH3 dư thu lấy kết tủa nung trong không khí đến khối lượng không đổi còn lại 2,11 gam chất rắn. Biết các phản ứng đều xảy ra hoàn toàn. Khối lượng muối trong X có thể là
A. 3,475 gam
B. 5,96 gam
C. 8,75 gam
D. 17,5 gam
Dung dịch X được tạo ra từ 2 muối gồm có các ion Al3+, Fe2+, Cl-. Chia dung dịch X làm 2 phần bằng nhau. Phần 1 đem tác dụng với dung dịch Ba(OH)2 dư thu được 6,46 gam kết tủa. Phần 2 đem tác dung với dung dich NH3 dư thu lấy kết tủa nung trong không khí đến khối lượng không đổi còn lại 2,11 gam chất rắn. Biết các phản ứng đều xảy ra hoàn toàn. Khối lượng muối trong X có thể là: A. 3,475 gam B. 5,96 gam C. 8,75 gam D. 17,5 gam
Đọc tiếp
Dung dịch X được tạo ra từ 2 muối gồm có các ion Al3+, Fe2+, Cl-. Chia dung dịch X làm 2 phần bằng nhau. Phần 1 đem tác dụng với dung dịch Ba(OH)2 dư thu được 6,46 gam kết tủa. Phần 2 đem tác dung với dung dich NH3 dư thu lấy kết tủa nung trong không khí đến khối lượng không đổi còn lại 2,11 gam chất rắn. Biết các phản ứng đều xảy ra hoàn toàn. Khối lượng muối trong X có thể là:
A. 3,475 gam
B. 5,96 gam
C. 8,75 gam
D. 17,5 gam
Một dung dịch X có chứa các ion:
H
+
,
A
l
3
+
,
S
O
4
2
-
và 0,1 mol . Nhỏ từ từ dung dịch NaOH đến dư vào X, kết quả thí nghiệm được biểu diễn trên đồ thị sau: Cho 200ml dung dịch Ba(OH)2 1,4M tác dụng với X thu được kết tủa Y và dung dịch Z. Biết các phản ứng xảy ra hoàn to...
Đọc tiếp
Một dung dịch X có chứa các ion: H + , A l 3 + , S O 4 2 - và 0,1 mol . Nhỏ từ từ dung dịch NaOH đến dư vào X, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
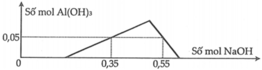
Cho 200ml dung dịch Ba(OH)2 1,4M tác dụng với X thu được kết tủa Y và dung dịch Z. Biết các phản ứng xảy ra hoàn toàn, khối lượng kết tủa Y là
A. 49,91gam
B. 49,72gam
C. 46,60gam
D. 51,28gam
Một dung dịch X có chứa các ion:
H
+
,
A
l
3
+
,
S
O
4
2
-
và 0,1 mol
C
l
-
. Nhỏ từ từ dung dịch NaOH đến dư vào X, kết quả thí nghiệm được biểu diễn trên đồ thị sau: Cho 200ml du...
Đọc tiếp
Một dung dịch X có chứa các ion: H + , A l 3 + , S O 4 2 - và 0,1 mol C l - . Nhỏ từ từ dung dịch NaOH đến dư vào X, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
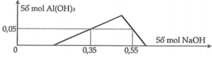
Cho 200ml dung dịch Ba(OH)2 1,4M tác dụng với X thu được kết tủa Y và dung dịch Z. Biết các phản ứng xảy ra hoàn toàn, khối lượng kết tủa Y là
A. 49,91gam
B. 49,72gam
C. 46,60gam
D. 51,28gam
Chọn đáp án B
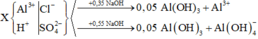
Nhánh 0,55 NaOH chỉ khác nhanh 0,35 NaOH một phản ứng là:

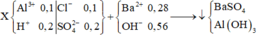

Đúng 0
Bình luận (0)
Dung dịch X chứa cac ion sau: Al3+, Cu2+ và SO42-. Để kết tủa hết ion có trong 250 ml dung dịch X cần 100ml dung dịch Bacl2 2M. Cho 500ml dung dịch X tác dụng với dd NH3 dư thì được 7,8 gam kết tủa. Cô cạn 500 ml dung dịch X thu được số gam muối là
\(Ba^{2+} + SO_4^{2-} \to BaSO_4\)
Trong 500 ml dung dịch X:
\(n_{SO_4^{2-}} = 2n_{BaCl_2} = 2.0,1.2 = 0,4(mol)\)
\(Al^{3+} + 3NH_3 + 3H_2O \to Al(OH)_3 + 3NH_4^+\)
\(n_{Al^{3+}} = n_{Al(OH)_3} = \dfrac{7,8}{78} = 0,1(mol)\)
Bảo toàn điện tích : \(n_{Cu^{2+}} = \dfrac{0,4.2-0,1.3}{2} = 0,25(mol)\)
Suy ra : mmuối = 0,1.27 + 0,25.64 + 0,4.96 = 57,1(gam)
Đúng 4
Bình luận (0)
Một dung dịch X có chứa các ion: x mol H+, y mol Al3+, z mol SO42- và 0,1 mol Cl-. Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch X, kết quả thí nghiệm được biểu diễn trên đồ thị sau: Cho 300 ml dung dịch Ba(OH)2 0,9M tác dụng với dung dịch X thu được kết tủa Y và dung dịch Z. Các phản ứng xảy ra hoàn toàn. Khối lượng kết tủa Y là A. 62,91gam B. 49,72gam C. 46,60 gam D. 51,28
Đọc tiếp
Một dung dịch X có chứa các ion: x mol H+, y mol Al3+, z mol SO42- và 0,1 mol Cl-. Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch X, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
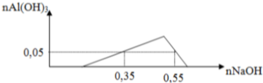
Cho 300 ml dung dịch Ba(OH)2 0,9M tác dụng với dung dịch X thu được kết tủa Y và dung dịch Z. Các phản ứng xảy ra hoàn toàn. Khối lượng kết tủa Y là
A. 62,91gam
B. 49,72gam
C. 46,60 gam
D. 51,28
Một dung dịch X có chứa các ion: x mol H+, y mol Al3+, z mol SO42- và 0,1 mol Cl-. Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch X, kết quả thí nghiệm được biểu diễn trên đồ thị sau: Cho 300 ml dung dịch Ba(OH)2 0,9M tác dụng với dung dịch X thu được kết tủa Y và dung dịch Z. Các phản ứng xảy ra hoàn toàn. Khối lượng kết tủa Y là A. 62,91gam. B. 49,72gam. C. 46,60 gam. D. 51,28 gam.
Đọc tiếp
Một dung dịch X có chứa các ion: x mol H+, y mol Al3+, z mol SO42- và 0,1 mol Cl-. Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch X, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
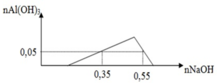
Cho 300 ml dung dịch Ba(OH)2 0,9M tác dụng với dung dịch X thu được kết tủa Y và dung dịch Z. Các phản ứng xảy ra hoàn toàn. Khối lượng kết tủa Y là
A. 62,91gam.
B. 49,72gam.
C. 46,60 gam.
D. 51,28 gam.
Đáp án D
Ta có: x = 0,35 – 0,05.3 = 0,2
Tại điểm kết tủa cực đại là
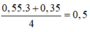
=> z = 0,2.
Khi thêm 0,27 Ba(OH)2 thì thu được kết tủa Z chứa
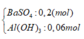
=> m = 51,28 gam
Đúng 0
Bình luận (0)
Một dung dịch X có chứa các ion: x mol H+, y mol Al3+, z mol SO42– và 0,1 mol Cl-. Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch X, kết quả thí nghiệm được biểu diễn trên đồ thị sau: Cho 300 ml dung dịch Ba(OH)2 0,9M tác dụng với dung dịch X thu được kết tủa Y và dung dịch Z. Khối lượng kết tủa Y là (các phản ứng xảy ra hoàn toàn) A. 62,91gam B. 49,72 gam. C. 46,60 gam D. 51,28 gam.
Đọc tiếp
Một dung dịch X có chứa các ion: x mol H+, y mol Al3+, z mol SO42– và 0,1 mol Cl-. Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch X, kết quả thí nghiệm được biểu diễn trên đồ thị sau:

Cho 300 ml dung dịch Ba(OH)2 0,9M tác dụng với dung dịch X thu được kết tủa Y và dung dịch Z. Khối lượng kết tủa Y là (các phản ứng xảy ra hoàn toàn)
A. 62,91gam
B. 49,72 gam.
C. 46,60 gam
D. 51,28 gam.
Chọn D.
- Tại vị trí n N a O H = 0 , 35 m o l ta có: n H + = n N a O H - 3 n A l ( O H ) 3 = 0 , 2 m o l
- Tại vị trí n N a O H = 0 , 55 m o l ta có: n A l 3 + = n N a O H + n A l ( O H ) 3 - n H + 4 = 0 , 1 m o l
- Xét dung dịch X , áp dụng bảo toàn điện tích ta suy ra: z = 0,2 mol.
- Khi cho 0,27 mol Ba(OH)2 tác dụng với dung dịch X thì kết tủa thu được gồm BaSO4 và Al(OH)3 với
n B a S O 4 = n S O 4 2 - = 0 , 2 m o l n A l ( O H ) 3 = 4 n A l 3 + - n O H - + n H + = 0 , 06 m o l ⇒ m k t u a = 51 , 28 g a m
Đúng 0
Bình luận (0)