Lập phương trình phản ứng õi hóa khử bằng phương pháp thăng bằng e
C3H8+HNO3---> CO2+NO+H2O
Thiết lập phương trình phản ứng oxi hóa - khử theo phương pháp thăng bằng electron?
Chỉ rõ chất khử, chất oxi hóa trong mỗi phản ứng.
1.S+ HNO3 → H2SO4 + NO.
2.C3H8 + HNO3 → CO2 + NO + H2O.
3.H2S + HClO3 → HCl + H2SO4
4.H2SO4 + C2H2 → CO2 + SO2 + H2O.
1)
Các quá trình
\(\overset{0}{S}\rightarrow\overset{+6}{S}+6e\) (Nhân với 1)
\(\overset{+5}{N}+3e\rightarrow\overset{+3}{N}\) (Nhân với 2)
\(\Rightarrow\) PTHH: \(S+2HNO_3\rightarrow H_2SO_4+2NO\)
2)
Các quá trình
\(\overset{-\dfrac{8}{3}}{C_3}H_8\rightarrow3\overset{+4}{C}+20e\) (Nhân với 3)
\(\overset{+5}{N}+3e\rightarrow\overset{+2}{N}\) (Nhân với 20)
\(\Rightarrow\) PTHH: \(3C_3H_8+20HNO_3\rightarrow9CO_2+22H_2O+20NO\)
3)
Các quá trình
\(\overset{-2}{S}\rightarrow\overset{+6}{S}+8e\) (Nhân với 3)
\(\overset{+5}{Cl}+6e\rightarrow\overset{-1}{Cl}\) (Nhân với 4)
\(\Rightarrow\) PTHH: \(3H_2S+4HClO_3\rightarrow4HCl+3H_2SO_4\)
4)
Các quá trình
\(\overset{+6}{S}+2e\rightarrow\overset{+4}{S}\) (Nhân với 5)
\(\overset{-1}{C_2}H_2\rightarrow2\overset{+4}{C}+10e\) (Nhân với 1)
\(\Rightarrow\) PTHH: \(5H_2SO_4+C_2H_2\rightarrow2CO_2+5SO_2+6H_2O\)
Thiết lập phương trình phản ứng oxi hóa - khử theo phương pháp thăng bằng electron?Chỉ rõ chất khử, chất oxi hóa trong mỗi phản ứng.
1.Al + HNO3 → Al(NO3)3 + NH4 NO3 + H2O.
2.Mg + HNO3 → Mg(NO3)2 + NO + H2O.
3.Mg + H2SO4 → MgSO4 + H2S + H2O.
4.Fe + H2SO4 → Fe2 (SO4)3 + SO2 + H2O.
1. Chất khử: Al
Chất oxi hóa: HNO3
\(Al\rightarrow Al^{3+}+3e|\times8\\ N^{+5}+8e\rightarrow N^{-3}|\times3\)
8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O.
2. Chất khử: Mg
Chất oxi hóa: HNO3
\(Mg\rightarrow Mg^{2+}+2e|\times3\\ N^{+5}+3e\rightarrow N^{+2}|\times2\)
3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4H2O.
3. Chất khử: Mg
Chất oxi hóa: H2SO4
\(Mg\rightarrow Mg^{2+}+2e|\times8\\ S^{+6}+8e\rightarrow S^{-2}|\times2\)
8Mg + 10H2SO4 → 8MgSO4 + 2H2S + 8H2O.
4.Chất khử: Fe
Chất oxi hóa: H2SO4
\(2Fe\rightarrow Fe^{3+}_2+6e|\times1\\ S^{+6}+2e\rightarrow S^{+4}|\times3\)
2Fe + 6H2SO4 → Fe2 (SO4)3 + 3SO2 + 6H2O.
Câu 1: Cân bằng các phương trình phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron. Cho biết chất oxi hóa và chất khử của mỗi phản ứng.
a) Fe2O3 + H2 -> Fe + H2O
b) Cu + HNO3 -> Cu(NO3)2 + NO + H2O
I/ Lập phương trình phản ứng oxi hóa khử bằng phương pháp thăng bằng e.
1. NH3 + O2 ->NO + H2O
2. Cu + Cl2 ->CuCl2
3. Na + H2O -> NaOH + H2
4 Fe + CuSO4 -> FeSO4 + Cu
5. Mg + HNO3 ->Mg(NO3)2 + NH4NO3 + H2O
6. Zn + H2SO4 ->ZnSO4 + H2S + H2O
7. MnO2 + HCl -> MnCl2 + Cl2 + H2O
8. KClO3 ->KCl + O2
9. Cl2 + KOH -> KCl + KClO3 + H2O
10. Fe3O4 + HNO3 -> Fe(NO3)3 + NO + H2O
11. M + HNO3 -> M(NO3)n + NO2 + H2O (Với M là kim loại hoá trị n)
12. C6H12O6 + H2SO4 đ -> SO2 + CO2 + H2O
1) 4NH3 + 5O2 --> 4NO + 6H2O
| N-3 -5e--> N+2 | x4 |
| O20 +4e--> 2O-2 | x5 |
2) Cu + Cl2 --> CuCl2
| Cu0-2e-->Cu+2 | x1 |
| Cl20 +2e--> 2Cl- | x1 |
3) 2Na + 2H2O --> 2NaOH + H2
| Na0-1e-->Na+ | x2 |
| 2H+ +2e--> H20 | x1 |
4) Fe + CuSO4 --> FeSO4 + Cu
| Fe0-2e-->Fe+2 | x1 |
| Cu+2 +2e--> Cu0 | x1 |
5) 4Mg + 10HNO3 --> 4Mg(NO3)2 + NH4NO3 + 3H2O
| Mg0-2e-->Mg+2 | x4 |
| N+5 +8e--> N-3 | x1 |
6) 4Zn + 5H2SO4 --> 4ZnSO4 + H2S + 4H2O
| Zn0-2e-->Zn+2 | x4 |
| S+6 +8e--> S-2 | x1 |
7) MnO2 + 4HCl --> MnCl2 + Cl2 + 2H2O
| Mn+4 +2e--> Mn+2 | x1 |
| 2Cl- -2e--> Cl20 | x1 |
8) 2KClO3 --to--> 2KCl + 3O2
| Cl+5 +6e--> Cl- | x2 |
| 2O-2 -4e--> O20 | x3 |
9) Cl2 + 6KOH --> 5KCl + KClO3 + 3H2O
| Cl0 +1e--> Cl- | x5 |
| Cl0 -5e--> Cl+5 | x1 |
10) 3Fe3O4 + 28HNO3 --> 9Fe(NO3)3 + NO + 14H2O
| \(Fe_3^{+\dfrac{8}{3}}-1e\rightarrow3Fe^{+3}\) | x3 |
| \(N^{+5}+3e\rightarrow N^{+2}\) | x1 |
11) M + 2nHNO3 --> M(NO3)n + nNO2 + nH2O
| M0-ne-->M+n | x1 |
| N+5 +1e--> N+4 | xn |
12) C6H12O6 + 12H2SO4 --> 12SO2 + 6CO2 + 18H2O
| C60-24e-->6C+4 | x1 |
| S+6 +2e--> S+4 | x12 |
Cân bằng phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron
M2On + HNO3 →M(NO3)3 + NO + H2O
3M2On + (24-2n)HNO3 --> 6M(NO3)3 + (6-2n)NO + (12-n)H2O
| M2+n -(6-2n)e--> 2M+3 | x3 |
| N+5 +3e--> N+2 | x(6-2n) |
Cân bằng PTHH của các phản ứng oxi hoá- khử sau bằng phương pháp thăng bằng electron (xác định chất khử, chất oxi hoá, quá trình khử, quá trình oxi hóa).
A l + H N O 3 → A l N O 3 3 + N O + N H 4 N O 3 + H 2 O
Cân bằng các phương trình phản ứng oxi hóa – khử sau bằng phương pháp thăng bằng electron:
a) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O.
b) HNO3 + HCl → NO + Cl2 + H2O.
c) HClO3 + HCl → Cl2 + H2O.
d) PbO2 + HCl → PbCl2 + Cl2 + H2O
Cân bằng các phản ứng oxi hóa – khử sau bằng phương pháp thăng bằng electron:
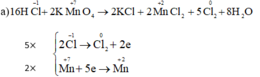
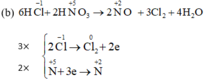
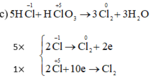
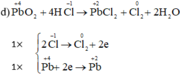
cân bằng phản ứng oxi hóa - khử theo phương pháp thăng bằng electron 1H2SO4+H2S->S+H2O
2 s+HNO3->H2SO4+NO
3I2+HNO3->HIO3+NO+H2O
4 NH3+O2->No+H2O
5 C+HNO3->NO2+CO2+H2O
6H2SO4+HI->I2+H2S+H2O
7P+KClO3->P2O5+KCl
8 NH3+CuO->Cu+H2O+N2
7) Cân bằng phản ứng oxi hóa khử bằng phương pháp thăng bằng electron. b) H2S + HNO3 -->S + NO + H2O c) Mg + HNO3 ⟶ Mg(NO3)2 + NO + H2O e) Al + H2SO4 → Al2(SO4)3 + SO2 + H2O g) Cu2S + HNO3 → Cu(NO3)2 + CuSO4 + NO + H2O
b)
$S^{-2} + 2e \to S^0$
$N^{+5} \to N^{+2} + 3e$
$3H_2S + 2HNO_3 \to 3S + 2NO + 4H_2O$
c)
$Mg^0 \to Mg^{+2} + 2e$
$N^{+5} + 3e \to N^{+2}$
$3Mg + 8HNO_3 \to 3Mg(NO_3)_2 + 2NO + 4H_2O$
e)
$Al^0 \to Al^{+3} + 3e$
$S^{+6} + 2e \to S^{+4}$
$2Al + 6H_2SO_4 \to Al_2(SO_4)_3 + 3SO_2 + 6H_2O$
g)
$Cu_2S \to 2Cu^{+2} + S^{+6} + 10e$
$N^{+5} + 3e \to N^{+2}$
$3Cu_2S + 16HNO_3 \to 3Cu(NO_3)_2 + 3CuSO_4 + 10NO + 8H_2O$