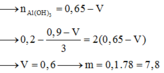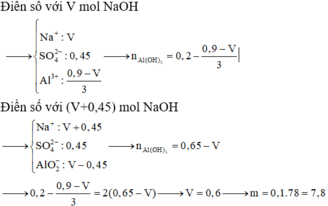Cho m gam kim loại Na vào 200g dung dịch Al2(SO4)3 1,71%.Sau khi phản ứng xong thu được 0,78g kết tủa.Tính m

Những câu hỏi liên quan
Cho m gam kim loại Na vào 200 gam dung dịch Al2(SO4)3 31,71%. Sau khi phản ứng xong thu được 0,78 gam kết tủa. m có giá trị là
A. 0,69 gam
B. 1,61 gam
C. Cả A và B đều đúng
D. đáp án khác
Cho m gam Na vào 200 gam dung dịch Al2(SO4)3 1,71%, sau khi phản ứng hoàn toàn thu được 0,78 gam kết tủa. Giá trị của m là
A. 1,61
B. 1,38 hoặc 1,61
C. 0,69 hoặc 1,61
D. 1,38
Đáp án C
• m gam Na + 0,01 mol Al2(SO4)3 → 0,01 mol ↓ Al(OH)3
• TH1: NaOH hết
2Na + 2H2O → 2NaOH + H2↑
6NaOH + Al2(SO4)3 → 2Al(OH)3↓ + 3Na2SO4
nNa = nNaOH = 0,01 × 3 = 0,03 mol → mNaOH = 0,03 × 23 = 0,69 gam.
• TH2: NaOH dư
2Na + 2H2O → 2NaOH + H2↑ (*)
6NaOH + Al2(SO4)3 → 2Al(OH)3↓ + 3Na2SO4 (**)
NaOH + Al(OH)3 → NaAlO2 + 2H2O (***)
Theo (**) nNaOH = 0,01 × 6 = 0,06 mol; nAl(OH)3 = 0,01 × 2 = 0,02 mol.
Theo (***) nAl(OH)3 phản ứng = 0,02 - 0,01 = 0,01 mol
→ nNaOH = 0,01 mol
→ ∑nNaOH = 0,06 + 0,01 = 0,07 mol
→ mNa = 0,07 × 23 = 1,61 gam
Đúng 0
Bình luận (0)
Cho mình hỏi bài này : Cho m gam kim loại Na vào 200 gam dd Al2(SO4)3 1,71%. Phản ứng xong thu được 0,78 gam kết tủa. Tính m? (Các bạn giải dễ hiểu giúp mình một chút)
\(2Na+2H_2O\rightarrow2NaOH+H_2\) (I)
\(6NaOH+Al_2\left(SO_4\right)_3\rightarrow3Na_2SO_4+2Al\left(OH\right)_3\) (1)
\(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\) (2)
\(m_{Al_2\left(SO_4\right)_3}=200.1,71\%=3,42g\Rightarrow n_{Al_2\left(SO_4\right)_3}=\dfrac{3,42}{342}=0,01mol\)
\(n_{Al\left(OH\right)_3}=\dfrac{0,78}{78}=0,01mol\)
TH1: Chỉ xảy ra pt1
\(n_{NaOH\left(1\right)}=3n_{Al\left(OH\right)_3}=0,03mol=n_{Na}\)
\(\Rightarrow m_{Na}=0,03.23=0,69g\)
TH2: Xảy ra cả pư 1,2
\(n_{Al\left(OH\right)_3\left(1\right)}=2n_{Al_2\left(SO_4\right)_3}=2.0,01=0,02mol\)
\(\Rightarrow n_{Al\left(OH\right)_3\left(2\right)}=0,02-0,01=0,01mol=n_{NaOH\left(2\right)}\)
\(n_{NaOH\left(1\right)}=0,06mol\)
\(\Rightarrow n_{NaOH\left(1+2\right)}=0,07mol=n_{NaOH\left(I\right)}=n_{Na}\)
\(\Rightarrow m_{Na}=0,07.23=1,61g.\)
Đúng 0
Bình luận (0)
Khối lượng muối Al2(SO4)3: m[Al2(SO4)3] = 200.1,71% = 3,42g
⇒ n[Al2(SO4)3] = 3,42/342 = 0,01mol
Lượng Na lớn nhất khi NaOH làm kết tủa hoàn toàn Al3+ và một phần kết tủa bị tan ra:
Al2(SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4
0,01 0,06 0,02
NaOH + Al(OH)3 → NaAlO2 + 2H2O
x x
Số mol kết tủa tạo thành:
n[Al(OH)3] = 0,02 - x = 0,78/78 = 0,01mol ⇒ x = 0,01mol
Vậy n(NaOH) = 0,06 + x = 0,06 + 0,01 = 0,07mol
Na + H2O → NaOH + 1/2H2
0,07 0,07
Khối lượng Na tối đa có thể dùng: m(Na) = 0,07.23 = 1,61g
Đúng 0
Bình luận (1)
Cho m gam Na tan hết trong 100ml dung dịch Al2(SO4)3 0,2M. Sau phản ứng thu được 0,78 gam kết tủa. Giá trị của m là
A. 0,69
B. 0,69 hoặc 3,45
C. 0,69 hoặc 3,68
D. 0,69 hoặc 2,76
Đáp án B
• m gam Na + 0,02 mol Al2(SO4)3 → 0,01 mol ↓
• TH1: NaOH hết
2Na + 2H2O → 2NaOH + H2↑
6NaOH + Al2(SO4)3 → 2Al(OH)3↓ + 3Na2SO4
nNa = nNaOH = 0,01 × 3 = 0,03 mol
→ mNa = 0,03 × 23 = 0,69 gam.
• TH2: NaOH dư
2Na + 2H2O → 2NaOH + H2↑ (*)
6NaOH + Al2(SO4)3 → 2Al(OH)3↓ + 3Na2SO4 (**)
NaOH + Al(OH)3 → NaAlO2 + 2H2O (***)
Theo (**) nNaOH = 0,02 × 6 = 0,12 mol; nAl(OH)3 = 0,02 × 2 = 0,04 mol.
Theo (***) nAl(OH)3 phản ứng = 0,04 - 0,01 = 0,03 mol
→ nNaOH = 0,03 mol
→ ∑nNaOH = 0,03 + 0,12 = 0,15 mol → nNa = 0,15 mol
→ mNa = 0,15 × 23 = 3,45 gam
Đúng 0
Bình luận (0)
Cho m gam hỗn hợp X gồm Na và K (tỉ lệ mol 1 : 1) vào 500 ml dung dịch chứa hỗn hợp gồm Al2(SO4)3 0,5M và H2SO4 1M sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho dung dịch Y tác dụng với 1,5 lít dung dịch HCl 1M, sau khi phản ứng xảy ra hoàn toàn thu được 23,4 gam kết tủa. Giá trị nhỏ nhất của m là A. 130,2 gam B. 27,9 gam C. 105,4 gam D. 74,4 gam
Đọc tiếp
Cho m gam hỗn hợp X gồm Na và K (tỉ lệ mol 1 : 1) vào 500 ml dung dịch chứa hỗn hợp gồm Al2(SO4)3 0,5M và H2SO4 1M sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho dung dịch Y tác dụng với 1,5 lít dung dịch HCl 1M, sau khi phản ứng xảy ra hoàn toàn thu được 23,4 gam kết tủa. Giá trị nhỏ nhất của m là
A. 130,2 gam
B. 27,9 gam
C. 105,4 gam
D. 74,4 gam
Có các thí nghiệm sau (a) Cho kim loại Na vào dung dịch CuSO4. (b) Sục CO2 đến dư vào dung dịch Ca(OH)2. (c) Cho từ từ dung dịch NaOH đến dư vào dung dịch Al2(SO4)3. (d) Cho từ từ dung dịch NaOH đến dư vào dung dịch FeCl3. Sau khi kết thúc các phản ứng, số thí nghiệm thu được kết tủa là A. 5 B. 3 C. 2 D. 4
Đọc tiếp
Có các thí nghiệm sau
(a) Cho kim loại Na vào dung dịch CuSO4.
(b) Sục CO2 đến dư vào dung dịch Ca(OH)2.
(c) Cho từ từ dung dịch NaOH đến dư vào dung dịch Al2(SO4)3.
(d) Cho từ từ dung dịch NaOH đến dư vào dung dịch FeCl3.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kết tủa là
A. 5
B. 3
C. 2
D. 4
Chọn C
(a) Cho kim loại Na vào dung dịch CuSO4
(d) Cho từ từ dung dịch NaOH đến dư vào dung dịch FeCl3
Đúng 0
Bình luận (0)
Có các thí nghiệm sau(a) Cho kim loại Na vào dung dịch CuSO4.(b) Sục CO2 đến dư vào dung dịch Ca(OH)2.(c) Cho từ từ dung dịch NaOH đến dư vào dung dịch Al2(SO4)3.(d) Cho từ từ dung dịch NaOH đến dư vào dung dịch FeCl3.Sau khi kết thúc các phản ứng, số thí nghiệm thu được kết tủa là A. 5 B. 3 C. 2. D. 4
Đọc tiếp
Có các thí nghiệm sau
(a) Cho kim loại Na vào dung dịch CuSO4.
(b) Sục CO2 đến dư vào dung dịch Ca(OH)2.
(c) Cho từ từ dung dịch NaOH đến dư vào dung dịch Al2(SO4)3.
(d) Cho từ từ dung dịch NaOH đến dư vào dung dịch FeCl3.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kết tủa là
A. 5
B. 3
C. 2.
D. 4
Đáp án C
2 thí nghiệm tạo ra kết tủa là (a), (d).
Đúng 0
Bình luận (0)
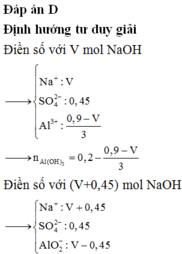
Dung dịch X chứa 0,15 mol H2SO4 và 0,1 mol Al2(SO4)3. Cho V ml dung dịch NaOH 1M vào dung dịch X, thu được m gam kết tủa. Thêm tiếp 450ml dung dịch NaOH 1M vào, sau khi các phản ứng xảy ra hoàn toàn thu được 0,5m gam kết tủa. Giá trị của m là: A. 4,68 gam B. 11,70 gam C. 3,90 gam D. 7,80 gam
Đọc tiếp
Dung dịch X chứa 0,15 mol H2SO4 và 0,1 mol Al2(SO4)3. Cho V ml dung dịch NaOH 1M vào dung dịch X, thu được m gam kết tủa. Thêm tiếp 450ml dung dịch NaOH 1M vào, sau khi các phản ứng xảy ra hoàn toàn thu được 0,5m gam kết tủa. Giá trị của m là:
A. 4,68 gam
B. 11,70 gam
C. 3,90 gam
D. 7,80 gam
Dung dịch X chứa 0,15 mol H2SO4 và 0,1 mol Al2(SO4)3. Cho V ml dung dịch NaOH 1M vào dung dịch X, thu được m gam kết tủa. Thêm tiếp 450ml dung dịch NaOH 1M vào, sau khi các phản ứng xảy ra hoàn toàn thu được 0,5m gam kết tủa. Giá trị của m là: A. 4,68 gam B. 11,70 gam C. 3,90 gam D. 7,80 gam
Đọc tiếp
Dung dịch X chứa 0,15 mol H2SO4 và 0,1 mol Al2(SO4)3. Cho V ml dung dịch NaOH 1M vào dung dịch X, thu được m gam kết tủa. Thêm tiếp 450ml dung dịch NaOH 1M vào, sau khi các phản ứng xảy ra hoàn toàn thu được 0,5m gam kết tủa. Giá trị của m là:
A. 4,68 gam
B. 11,70 gam
C. 3,90 gam
D. 7,80 gam