Xác định được: nguyên tử khối, nguyên tử khối trung bình và phần trăm số nguyên tử các đồng vị của một nguyên tố hóa học.

Những câu hỏi liên quan
Dưới đây là thành phần phần trăm của các đồng vị thuộc hai nguyên tố
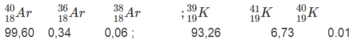
Hãy tính nguyên tử khối trung bình của Ar và K (một cách gần đúng coi nguyên tử khối của các đồng vị trùng với số khối của chúng).
Nguyên tử khối trung bình của Ar :
![]()
Nguyên tử khối trung bình của K :
![]()
Đúng 0
Bình luận (0)
Người ta gọi khối lượng nguyên tử của một nguyên tố hoá học là khối lượng trung bình của một nguyên tử chất đó (tính theo đơn vị u). Vì trong một khối chất hoá học trong thiên nhiên bao giờ cũng chứa một số đồng vị của chất đó với những tỉ lệ xác định, nên khối lượng nguyên tử của mội nguyên tố hoá học không bao giờ là một số nguyên, trong khi đó, số khối của một hạt nhân bao giờ cũng là một số nguyên.Neon thiên nhiên có ba thành phần là
N...
Đọc tiếp
Người ta gọi khối lượng nguyên tử của một nguyên tố hoá học là khối lượng trung bình của một nguyên tử chất đó (tính theo đơn vị u). Vì trong một khối chất hoá học trong thiên nhiên bao giờ cũng chứa một số đồng vị của chất đó với những tỉ lệ xác định, nên khối lượng nguyên tử của mội nguyên tố hoá học không bao giờ là một số nguyên, trong khi đó, số khối của một hạt nhân bao giờ cũng là một số nguyên.
Neon thiên nhiên có ba thành phần là N 10 20 e ; N 10 21 e ; N 10 22 e và trong đó thành phần N 10 21 e chỉ chiếm 0,26 %, còn lại chủ yếu là hai thành phần kia. Khối lượng nguyên tử của neon là 20,179. Tính tỉ lệ phần trăm của các thành phần N 10 20 e ; N 10 22 e
Ta có : 20x + 22y + 21.0,0026 = 20,179
x + y = 0,9974
Giải hệ hai phương trình trên, ta được :
20x + 22(0,9974 - x) = 20,1244
x = 0,9092
y = 0,0882
Vậy, thành phần nêon ( N 10 20 e ) trong nêon thiên nhiên là 90,92% và thành phần nêon ( N 10 20 e ) là 8,82%.
Đúng 0
Bình luận (0)
Một nguyên tố X chủ yếu gồm hai đồng vị bền là X1 và X2. Đồng vị X1 có tổng số hạt là 18. Đồng vị X2 có số hạt mang điện nhiều hơn số hạt không mang điện là 5. Nguyên tử khối trung bình của X là 12,011. Xác định phần trăm số nguyên tử của các đồng vị X1, X2.
Đồng có 2 đồng vị : và , nguyên tử khối trung bình của nguyên tố Cu là 63,54.a. Tính phần trăm số nguyên tử của từng đồng vị của nguyên tố Cu.b. Tính phần trăm khối lượng của đồng vị chứa trong CuSO4. ( với O là đồng vị , S là đồng vị )c. Tính số nguyên tử của đồng vị có trong 35,77 gam Cu2O.Câu 10. Viết cấu hình electron của các nguyên tử có phân lớp ngoài cùng là 4s1
Đọc tiếp
Đồng có 2 đồng vị : và , nguyên tử khối trung bình của nguyên tố Cu là 63,54.
a. Tính phần trăm số nguyên tử của từng đồng vị của nguyên tố Cu.
b. Tính phần trăm khối lượng của đồng vị chứa trong CuSO4. ( với O là đồng vị , S là đồng vị )
c. Tính số nguyên tử của đồng vị có trong 35,77 gam Cu2O.
Câu 10. Viết cấu hình electron của các nguyên tử có phân lớp ngoài cùng là 4s1
Nguyên tử của nguyên tố X có 2 đồng vị A và B. % về số nguyên tử của đồng vị A gấp 1,174 lần % về số nguyên tử của đồng vị B. Đồng vị A có 35 proton và 44 notron. Tổng số khối của hai đồng vị llà160. Xác định nguyên tử khối trung bình của X?
Nguyên tố Cu có nguyên tử khối trung bình là 63,54 có 2 đồng vị X và Y, biết tổng số khối là 128. Số nguyên tử đồng vị X bằng 0,37 số nguyên tử đồng vị Y. Vậy phần trăm của từng đồng vị là
A. 73 và 27
B. 27 và 73
C. 54 và 46
D. 46 và 54
Đáp án B.
Gọi số khối của hai đồng vị X, Y là A1 và A2; phần trăm số nguyên tử của hai đồng vị này là x1 và x2. Theo giả thiết ta có:
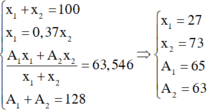
Đúng 0
Bình luận (0)
Trong tự nhiên, nguyên tố đồng có hai đồng vị là C 29 63 u và C 29 65 u . Nguyên tử khối trung bình của đồng là 63,54. Thành phần phần trăm tổng số nguyên tử của đồng vị là
A. 27%.
B. 50%.
C. 73%.
D. 54%.
Nguyên tố Cu có nguyên tử khối trung bình là 63,54 có hai đồng vị Y và Z, biết tổng số khối là 128. Số nguyên tử đồng vị Y = 0,37 lần số nguyên tử đồng vị Z. Xác định số khối của Y và Z.
Hoá 10 khó quá mong các bạn giúp đỡ !!!!!!!!
=xA1+x2A2/x+x2 (trong đó x là số nguyên tử của A1, x2 là số nguyên tử của A2) M la nguyên tử khối trung bình
Đúng 0
Bình luận (0)
gọi a là số khối của Y( số khối của Y lớn hơn của Z ) --> ta có số khối của Z là 128-a ta có sơ đồ đường chéo
Y (a) 63,54-(128-a)
Z (128-a) 63,54 a-63,54
từ số nguyên tử đồng vị Y = 0,37 lần số nguyên tử đồng vị Z. Xác định số khối của Y và Z.ta có
63,54-(128-a)=0,37*(a-63,54) sau đó giải a là xong chúc bạn học tốt
Đúng 1
Bình luận (3)
Đồng trong tự nhiên có 2 đồng vị là 63Cu và 65Cu. Nguyên tử khối trung bình là 63,54.
a/ Xác định phần trăm của mỗi loại đồng vị.
b/ Hỏi mỗi khi có 108 nguyên tử 65Cu thì có bao nhiêu nguyên tử 63Cu?
c/ Tính phần trăm khối lượng của đồng vị 65Cu lần lượt trong Cu2O và CuCl2












