Cho 100 ml dung dịch NaOH 3M tác dụng với 100 ml dung dịch AgCl3 2M. Kết thúc phản ứng, thu được m gam kết tủa. Giá trị của m là
A. 23,4
B. 7,8
C. 15,6
D. 3,9
Cho 100 ml dung dịch NaOH 3M tác dụng với 100 ml dung dịch AgCl3 2M. Kết thúc phản ứng, thu được m gam kết tủa. Giá trị của m là
A. 23,4
B. 7,8
C. 15,6
D. 3,9
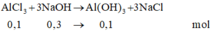
⇒ m A l O H 3 = 7 , 8 g
=> Chọn đáp án B.
Nhỏ từ từ đến hết 100 ml dung dịch chứa K2CO3 2M và KHCO3 3M vào 200 ml dung dịch HCl 2,1M, thu được khí CO2. Dẫn toàn bộ khí CO2 thu được vào 100 ml dung dịch chứa NaOH 2M và Ba(OH)2 0,8M, kết thúc các phản ứng thu được m gam kết tủa. Giá trị của m là
A. 31,52.
B. 15,76.
C. 11,82.
D. 27,58.
Đáp án C
n C O 3 2 - = 0,2 mol; n H C O 3 - = 0,3 mol.
→ tỉ lệ 2 : 3.
→ 2x và 3x là số mol CO32– và HCO32– đã phản ứng
→ n H + = 2x.2 + 3x = 0,42 => x = 0,06 → n C O 2 = 2x + 3x = 0,3 mol.
Có n O H - = 0,36
Xét tỉ lệ T = n O H - n C O 2 thấy tạo ra đồng thời 2 muối CO32– và HCO3–.
→ n C O 3 2 - = 0,06; n H C O 3 - = 0,24
n B a 2 + = 0,08 → n B a C O 3 = 0,06 → m B a C O 3 = 11,82 gam.
Nhỏ từ từ đến hết 100 ml dung dịch chứa K2CO3 2M và KHCO3 3M vào 200 ml dung dịch HCl 2,1M, thu được khí CO. Dẫn toàn bộ khí CO thu được vào 100 ml dung dịch chứa NaOH 2M và Ba(OH)2 0,8M, kết thúc các phản ứng thu được m gam kết tủa. Giá trị của m là
A. 11,82
B. 15,76
C. 27,58
D. 31,52
Chọn A.
n(CO32-) = 0,2 mol; n(HCO3-) = 0,3 mol.
→ tỉ lệ 2 : 3.
→ 2x và 3x là số mol CO32- và HCO32- đã phản ứng
→ n(H+) = 2x.2 + 3x = 0,42 => x = 0,06 → n(CO2) = 2x + 3x = 0,3 mol.
Có n(OH-) = 0,36
Xét tỉ lệ T = n(OH-) / n(CO2) thấy tạo ra đồng thời 2 muối CO32- và HCO3-.
→ n(CO32-) = 0,06; n(HCO3-) = 0,24
n(Ba2+) = 0,08 → n(BaCO3) = 0,06 → m(BaCO3) = 11,82 gam
Nhỏ từ từ đến hết 100 ml dung dịch chứa K2CO3 2M và KHCO3 3M vào 200 ml dung dịch HCl 2,1M, thu được khí CO2. Dẫn toàn bộ khí CO2 thu được vào 100 ml dung dịch chứa NaOH 2M và Ba(OH)2 0,8M, kết thúc các phản ứng thu được m gam kết tủa. Giá trị của m là
A. 31,52.
B. 15,76.
C. 11,82.
D. 27,58.
Đáp án C
n(CO32–) = 0,2 mol; n(HCO3–) = 0,3 mol.
→ tỉ lệ 2 : 3.
→ 2x và 3x là số mol CO32– và HCO32– đã phản ứng
→ n(H+) = 2x.2 + 3x = 0,42 => x = 0,06 → n(CO2) = 2x + 3x = 0,3 mol.
Có n(OH–) = 0,36
Xét tỉ lệ T = n(OH–) / n(CO2) thấy tạo ra đồng thời 2 muối CO32– và HCO3–.
→ n(CO32–) = 0,06; n(HCO3–) = 0,24
n(Ba2+) = 0,08 → n(BaCO3) = 0,06 → m(BaCO3) = 11,82 gam.
Cho 200 ml dung dịch NaOH 2M tác dụng hoàn toàn với 200 ml dung dịch AlCl 3 aM. Sau phản ứng thu được 7,8 gam kết tủa nhôm hiđroxit. Giá trị của a là:
A. 0,5M
B. 0,625M
C. 2M
D. Cả A và B
Hòa tan hết m gam Al 2 SO 4 3 vào H 2 O thu được 300 ml dung dịch X. Cho 150 ml dung dịch X tác dụng với dung dịch chứa 0,3 mol NaOH, kết thúc các phản ứng thu được 2a gam kết tủa (TN1). Mặt khác, cho 150 ml dung dịch X còn lại phản ứng với dung dịch chứa 0,55 mol KOH, kết thúc các phản ứng thu được a gam kết tủa (TN2). Giá trị của m và a lần lượt là
A. 51,30 và 3,9
B. 64,8 và 19,5
C. 25,65 và 3,9
D. 34,2 và 19,5
Đáp án A
Trong 300 ml dung dịch X có m gam Al 2 SO 4 3 , suy ra trong 150 ml dung dịch X sẽ có 0,5m gam Al 2 SO 4 3 và có số mol là x.
Lượng Al 2 SO 4 3 phản ứng ở 2 thí nghiệm là như nhau. Lượng OH - ở TN2 nhiều hơn ở TN1, lượng kết tủa (y mol) ở TN2 ít hơn ở TN1 (2y mol). Chứng tỏ ở TN2 kết tủa Al OH 3 đã bị hòa tan một phần, ở TN1 kết tủa có thể bị hòa tan hoặc chưa bị hòa tan.
● Nếu ở TN1 kết tủa Al OH 3 chưa bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :
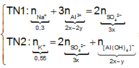
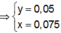
![]() thỏa mãn
thỏa mãn
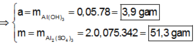
● Ở TN1 kết tủa Al OH 3 đã bị hòa tan, áp dụng bảo toàn điện tích cho dung dịch sau phản ứng, ta có:
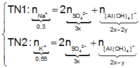
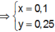
![]() (loại) (*)
(loại) (*)
PS : Nếu không sử dụng biểu thức (*) để biện luận loại trường hợp không thỏa mãn thì sẽ tính ra đáp án B. Nhưng đó là kết quả sai.
Cho 5,4 gam Al tác dụng với 100 ml dung dịch X chứa F e N O 3 2 2M và C u N O 3 2 3M. Sau khi phản ứng kết thúc thu được m gam chất rắn. Giá trị của m là
A. 9,6
B. 19,2
C. 30,4
D. 17,6
Sục 6,72 lít C O 2 (đktc) vào 100 ml dung dịch X gồm C a O H 2 1M và NaOH 2M. Sau phản ứng thu được m 1 gam kết tủa và dung dịch X. Cho dung dịch X tác dụng với 100 ml dung dịch C a C l 2 1M; KOH 0,5M thu được m 2 gam kết tủa. Giá trị của m2 là:
A. 2 gam
B. 5 gam
C. 4 gam
D. 8 gam
Khi cho 200 ml dung dịch NaOH aM vào 500 ml dung dịch AlCl3 bM thu được 15,6 gam kết tủa. Mặt khác, nếu cho 400 ml dung dịch NaOH aM vào 500 ml dung dịch AlCl3 bM thì thu được 23,4 gam kết tủa. Các phản ứng đều xảy ra hoàn toàn. Giá trị của a và b lần lượt là
A. 3,00 và 0,75
B. 3,00 và 0,50
C. 3,00 và 2,50
D. 2,00 và 3,00
Nhận thấy khi lượng NaOH tăng lên, lượng AlCl3 không đổi thì lượng kết tủa tăng lên → thí nghiệm 1 thì NaOH hết, AlCl3 còn dư ; thí nghiệm 2 cả NaOH và AlCl3 đều hết (xảy ra hiện tượng hòa tan kết tủa)
Thí nghiệm 1: Ta có 3× nkết tủa = nOH- = 0,6 mol → 0,2a= 0,6 → a= 3
Thí nghiệm 2:Ta có 4×nAl3+ = nOH- + nkết tủa → 4×0,5b= 0,4×3 + 0,3 → b= 0,75
Đáp án A