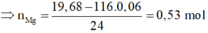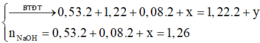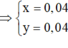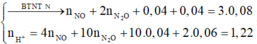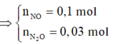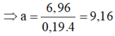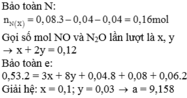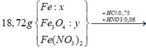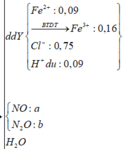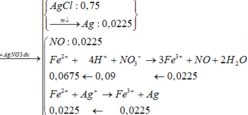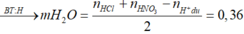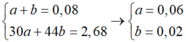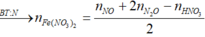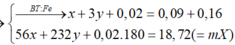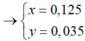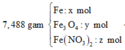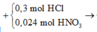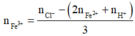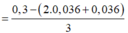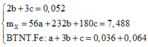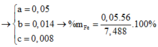Cho 19,68 gam hỗn hợp gồm Mg, FeCO3 vào dung dịch chứa 1,22 mol NaHSO4 và 0,08 mol Fe(NO3)3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thấy thoát ra hỗn hợp khí X gồm NO, N2O và 0,06 mol CO2; đồng thời thu được dung dịch Y và 3,36 gam một kim loại không tan. Để tác dụng tối đa các chất tan trong dung dịch Y cần dùng dung dịch chứa 1,26 mol NaOH. Tỉ khối của X so với He bằng a. Giá trị gần nhất với a là
A. 10,2.
B. 10,4.
C. 10,6
D. 10,0.