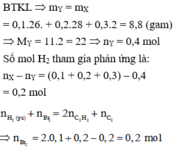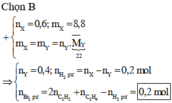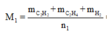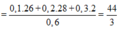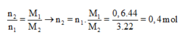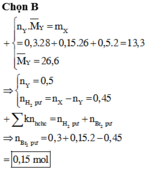Hỗn hợp khí X gồm 0,1 mol CH2CH–C–CH, 0,2 mol CH2CH–CHO, 0,3 mol C2H4 và 0,4 mol H2. Đun nóng X với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 16. Hỗn hợp Y phản ứng tối đa với a mol Br2 trong dung dịch. Giá trị của a là A. 0,8 B. 1,0 C. 0,4 D. 0,6
Đọc tiếp
Hỗn hợp khí X gồm 0,1 mol CH2=CH–C–CH, 0,2 mol CH2=CH–CHO, 0,3 mol C2H4 và 0,4 mol H2. Đun nóng X với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 16. Hỗn hợp Y phản ứng tối đa với a mol Br2 trong dung dịch. Giá trị của a là
A. 0,8
B. 1,0
C. 0,4
D. 0,6