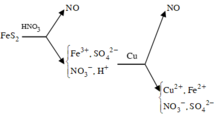
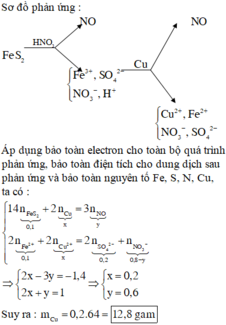
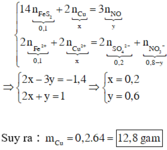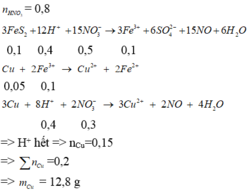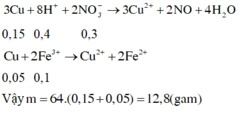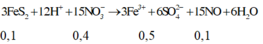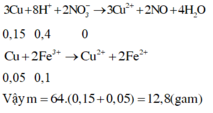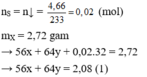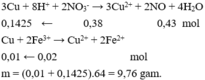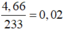Hòa tan hết 2,72 gam hỗn hợp X gồm FeS2, FeS, Fe, CuS và Cu trong 500 ml dung dịch HNO3 1M, sau khi kết thúc các phản ứng thu được dung dịch Y và 0,07 mol một chất khí thoát ra. Cho Y tác dụng với lượng dư dung dịch BaCl2 thu được 4,66 gam kết tủa. Mặt khác, dung dịch Y có thể hòa tan tối đa m gam Cu. Biết trong các quá trình trên, sản phẩm khử duy nhất của N+5 là NO. Giá trị của m là A. 5,92 B. 4,96 C. 9,76 D. 9,12
Đọc tiếp
Hòa tan hết 2,72 gam hỗn hợp X gồm FeS2, FeS, Fe, CuS và Cu trong 500 ml dung dịch HNO3 1M, sau khi kết thúc các phản ứng thu được dung dịch Y và 0,07 mol một chất khí thoát ra. Cho Y tác dụng với lượng dư dung dịch BaCl2 thu được 4,66 gam kết tủa. Mặt khác, dung dịch Y có thể hòa tan tối đa m gam Cu. Biết trong các quá trình trên, sản phẩm khử duy nhất của N+5 là NO. Giá trị của m là
A. 5,92
B. 4,96
C. 9,76
D. 9,12