Khi điện phân một dung dịch chứa Na 2 SO 4 , Al 2 SO 4 3 và H 2 SO 4 , quá trình đầu tiên xảy ra ở catot là:
A. 2 H 2 O + 2 e → H 2 + 2 OH -
B. Na + + 1 e → Na
C. Al 3 + + 3 e → Al
D. 2 H + + 2 e → H 2
Thực hiện các thí nghiệm sau:
(1) Cho bột Fe vào dung dịch CuCl2.
(2) Điện phân dung dịch CuSO4 bằng điện cực trơ.
(3) Điện phân nóng chảy Al2O3.
(4) Nung nóng hỗn hợp gồm Al và Fe2O3 (tỉ lệ mol 2 : 1)
(5) Thổi luồng khí CO đến dư qua ống sứ chứa CuO.
(6) Cho Na vào dung dịch CuSO4.
Sau khi kết thúc thí nghiệm, số trường hợp thu được đơn chất là
A. 6.
B. 4.
C. 5
D. 3
Có các phát biểu sau:
(1) Kim loại Cu khử được ion Fe2+ trong dung dịch.
(2) Không thể điều chế kim loại Na bằng phương pháp điện phân dung dịch muối ăn.
(3) Khi cho CrO3 tác dụng với nước tạo thành dung dịch chứa hai axit.
(4) Al(OH)3 vừa tác dụng được với dung dịch NaOH vừa tác dụng được với dung dịch HCl.
(5) Để dây thép ngoài không khí ẩm, sau một thời gian thấy dây thép bị ăn mòn điện hóa.
(6) Tính oxi hóa của ion Cu2+ mạnh hơn ion Fe3+.
Số phát biểu đúng là
A. 5.
B. 3.
C. 4.
D. 2.
Đáp án C
(1) Sai, Kim loại Cu không khử được ion Fe2+ trong dung dịch.
(6) Sai, Tính oxi hóa của ion Cu2+ yếu hơn ion Fe3+.
Điện phân 100ml dung dịch A chứa Cu2+, Na+; H+; SO42- có pH = 1, điện cực trơ. Sau một thời gian điện phân, rút điện cực ra khỏi dung dịch, thấy khối lượng dung dịch giảm 0,64 gam và dung dịch có màu xanh nhạt, thể tích dung dịch không đổi. Tính nồng độ H+ có trong dung dịch sau khi điện phân.
A. 0,2 M
B. 0,1 M.
C. 0,16 M.
D. 0,26 M.
Đáp án D.
Dung dịch sau có màu xanh nhạt nghĩa là vẫn còn ít ion đồng ⟹ H+ chưa bị điện phân.
Gọi số mol Cu2+ điện phân là a (mol) còn số mol O2 tạo ra ở anot là b (mol).
Bảo toàn e suy ra: a = 2b
Khối lượng dung dịch giảm gồm khối lượng Cu và khối lượng khí oxi sinh ra nên:
64a + 32b = 0,64
Từ hai phương trình trên suy ra: b = 0,004 (mol); a =0,008 (mol).
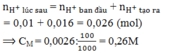
Thực hiện các thí nghiệm sau:
(1) Sục khí CO2 đến dư vào dung dịch NaAlO2 hay Na[Al(OH)4]
(2) Sục khí NH3 đến dư vào dung dịch AlCl3
(3) Cho dung dịch NaOH đến dư vào dung dịch AlCl3
(4) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3
(5) Cho AgNO3 vào dung dịch FeCl3
(6) Cho mẩu Na vào dung dịch CuSO4
(7) Điện phân dung dịch AlCl3
Sau khi kết thúc các thí nghiệm, tổng số thí nghiệm thu được kết tủa là:
A. 6
B. 3
C. 4
D. 5
Đáp án A
Các trường hợp thỏa mãn: 1-2-4-5-6-7
Thực hiện các thí nghiệm sau.
(1) Sục khí CO2 đến dư vào dung dịch NaAlO2 hay Na[Al(OH)4].
(2) Sục khí NH3 đến dư vào dung dịch AlCl3.
(3) Cho dung dịch NaOH đến dư vào dung dịch AlCl3.
(4) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3.
(5) Cho AgNO3 vào dung dịch FeCl3.
(6) Cho mẩu Na vào dung dịch CuSO4.
(7) Điện phân dung dịch AlCl3.
Sau khi kết thúc các thí nghiệm, tổng số thí nghiệm thu được kết tủa là.
A. 6
B. 3
C. 4
D. 5
Đáp án A
Các thí nghiệm thu được kết tủa là 1,2,4,5,6,7,8
Thực hiện các thí nghiệm sau:
(1) Sục khí CO2 đến dư vào dung dịch NaAlO2 hay Na[Al(OH)4]
(2) Sục khí NH3 đến dư vào dung dịch AlCl3
(3) Cho dung dịch NaOH đến dư vào dung dịch AlCl3
(4) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3
(5) Cho AgNO3 vào dung dịch FeCl3
(6) Cho mẩu Na vào dung dịch CuSO4
(7) Điện phân dung dịch AlCl3
Sau khi kết thúc các thí nghiệm, tổng số thí nghiệm thu được kết tủa là:
A. 6
B. 3
C. 4
D. 5
Các trường hợp thỏa mãn: 1-2-4-5-6-7
ĐÁP ÁN A
Dung dịch X chứa a mol CuSO4 và b mol NaCl. Điện phân dung dịch X với điện cực trơ màng ngăn xốp cường độ I = 5A. Khi điện phân X trong t giây thu được dung dịch Y thấy khối lượng dung dịch giảm 29,1 gam trong đó ở anot thu được hỗn hợp khí Y có tỉ khối so với hiđro là 229/7. Cho Ba(OH)2 dư vào dung dịch sau điện phân thu được 135,36 gam kết tủa. Cho các phát biểu sau:
(1) Khối lượng kim loại bám vào catot là 15,36 gam
(2) Khối lượng chất tan trong dung dịch X là 97,86 gam.
(3) Lượng khí sinh ra ở anot oxi hoá vừa đủ 4,68 gam hỗn hợp Al và Mg có tỉ lệ số mol Al : Mg = 2 : 1
(4) Điện phân X trong 20072 giây thì tổng số mol khí thoát ra là 0,42 mol
Số phát biểu đúng là
A. 4
B. 3
C. 2
D. 1
Đáp án B
Ở anot thu được hỗn hợp khí gồm Cl2 và O2, dựa vào tỉ khối ta có tỉ lệ số mol 2 khí này là 6:1.
Gọi số mol O2 là x mol suy ra số mol Cl2 là 6x.
Ở catot thu được Cu 8x mol.
Khối lượng dung dịch giảm là do O2, Cu, Cl2 thoát ra
![]()
Giải được: x=0,03
![]()
Khối lượng kim loại Cu bàm vào catot là 158,36 gam.
Cho Ba(OH)2 dư vào dung dịch sau điện phân kết tủa thu được gồm a mol BaSO4 và a-0,24 mol Cu(OH)2.
![]()
Giải được a=0,48.
Khối lượng chất tan trong X là 97,86 gam.
4,68 gam hỗn hợp Al và Mg có tỉ lệ số mol 2:1 gồm có 0,12 mol Al và 0,06 mol Mg.
Ta có: ![]()
nên lượng khí oxi hóa vừa đủ.
Điện phân X trong 20072 giây tức số mol e là 1,04 mol.
Ở catot thu được Cu 0,48 mol và H2 0,04 mol.
Ở anot thu được Cl2 0,18 mol và O2 0,17 mol.
Tổng số mol khí thoát ra là 0,39 mol
Dung dịch X chứa a mol CuSO4 và b mol NaCl. Điện phân dung dịch X với điện cực trơ màng ngăn xốp cường độ I = 5A. Khi điện phân X trong t giây thu được dung dịch Y thấy khối lượng dung dịch giảm 29,1 gam trong đó ở anot thu được hỗn hợp khí Y có tỉ khối so với hiđro là 229/7. Cho Ba(OH)2 dư vào dung dịch sau điện phân thu được 135,36 gam kết tủa. Cho các phát biểu sau:
(1) Khối lượng kim loại bám vào catot là 15,36 gam
(2) Khối lượng chất tan trong dung dịch X là 97,86 gam.
(3) Lượng khí sinh ra ở anot oxi hoá vừa đủ 4,68 gam hỗn hợp Al và Mg có tỉ lệ số mol Al : Mg = 2 : 1
(4) Điện phân X trong 20072 giây thì tổng số mol khí thoát ra là 0,42 mol
Số phát biểu đúng là
A. 4
B. 3
C. 2
D. 1
Đáp án B
Ở anot thu được hỗn hợp khí gồm Cl2 và O2, dựa vào tỉ khối ta có tỉ lệ số mol 2 khí này là 6:1.
Gọi số mol O2 là x mol suy ra số mol Cl2 là 6x.
Ở catot thu được Cu 8x mol.
Khối lượng dung dịch giảm là do O2, Cu, Cl2 thoát ra → 32x+64.8x+71.6x = 29,1
Giải được: x=0,03
→ b = 6x.2 = 0,36
Khối lượng kim loại Cu bàm vào catot là 158,36 gam.
Cho Ba(OH)2 dư vào dung dịch sau điện phân kết tủa thu được gồm a mol BaSO4 và a-0,24 mol Cu(OH)2.
→ 233a + (a - 0,24).98 = 135,36
Giải được a=0,48.
Khối lượng chất tan trong X là 97,86 gam.
4,68 gam hỗn hợp Al và Mg có tỉ lệ số mol 2:1 gồm có 0,12 mol Al và 0,06 mol Mg.
Ta có: 0,12.3+0,06.2 = 0,18.2+0,03.4 nên lượng khí oxi hóa vừa đủ.
Điện phân X trong 20072 giây tức số mol e là 1,04 mol.
Ở catot thu được Cu 0,48 mol và H2 0,04 mol.
Ở anot thu được Cl2 0,18 mol và O2 0,17 mol.
Tổng số mol khí thoát ra là 0,39 mol
Dung dịch X chứa a mol CuSO4 và b mol NaCl. Điện phân dung dịch X với điện cực trơ màng ngăn xốp cường độ I = 5A. Khi điện phân X trong t giây thu được dung dịch Y thấy khối lượng dung dịch giảm 29,1 gam trong đó ở anot thu được hỗn hợp khí Y có tỉ khối so với hiđro là 229/7. Cho Ba(OH)2 dư vào dung dịch sau điện phân thu được 135,36 gam kết tủa. Cho các phát biểu sau:
(1) Khối lượng kim loại bám vào catot là 15,36 gam.
(2) Khối lượng chất tan trong dung dịch X là 97,86 gam.
(3) Lượng khí sinh ra ở anot oxi hoá vừa đủ 4,68 gam hỗn hợp Al và Mg có tỉ lệ số mol Al : Mg = 2 : 1.
(4) Điện phân X trong 20072 giây thì tổng số mol khí thoát ra là 0,42 mol.
Số phát biểu đúng là:
A. 2
B. 4
C. 1
D. 3
Điện phân (với điện cực trơ, màng ngăn xốp) dung dịch X chứa CuSO4 và NaCl ( có tỷ lệ mol tương ứng 3:2) bằng dòng điện một chiều có cường độ 5A, sau thời gian t giờ thu được dung dịch Y chứa hai chất tan và thấy khối lượng dung dịch Y giảm 33,1 gam so với khối lượng dung dịch X. Dung dịch Y hòa tan tối đa 3,6 gam Al. Giả sử khí sinh ra trong quá trình điện phân thoát hết ra khỏi dung dịch. Giá trị của t gần nhất với giá trị nào sau đây?
A. 4,50.
B. 6,00.
C. 5,36.
D. 6,66.