Cho quá trình: F e → F e 3 + + 3 e Quá trình trên là quá trình
A. khử
B. oxi hoá
C. nhận electron
D. trao đổi
Khi quan sát quá trình phần bào của một tế bào sinh dưỡng ở một loài sinh vật có bộ NST lưỡng bội 2n, một học sinh vẽ lại được sơ đồ với đầy đủ các giai đoạn khác nhau như sau:

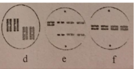
Cho các phát biểu sau đây:
(1) Quá trình phân bào này mô tả cơ chế tạo thể lệch bội trong giảm phân.
(2) Quá trình phân bào này có một cặp NST không phân li trong nguyên phân.
(3) Bộ NST lưỡng bội của loài trên là 2n=8
(4) Ở giai đoạn (f), tế bào có 8 phân tử ADN thuộc 4 cặp NST.
(5) Thứ tự các giai đoạn xảy ra là: (b) → (d)→ (f)→ (e) →(a) và (c)
Số phát biểu đúng là:
A. 4
B. 2
C. 3
D. 1
Đáp án C
(1) Sai. Đây là các giai đoạn trong nguyên phân vì các NST kép xếp 1 hàng, nếu là giảm phân phải xếp 2 hàng và số hình đó không đủ tất cả các giai đoạn
(2) Đúng. Cặp NST không phân li trong hình e
(3) Sai.
(4) Đúng
(5) Đúng.
Cho nguyên tử các nguyên tố sau: K (Z = 19), Ca (Z = 20), Al (Z = 13), F (Z =9), Br (Z = 35). Viết cấu hình e và quá trình hình thành ion tương ứng của các nguyên tử trên.
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.
B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.
B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường = tổng số e nhận
B 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)
Mg + H2SO 4 → MgSO4 + H2S + H2O.
\(B1.\overset{0}{Mg}+H_2\overset{+6}{S}O_4\rightarrow\overset{2+}{Mg}SO_4+H_2\overset{2-}{S}+H_2O\\ B2+B3.QToxh:Mg\rightarrow Mg^{2+}+2e|\times4\\ QTkhử:S^{+6}+8e\rightarrow S^{2-}|\times1\\ B4.4Mg+5H_2SO_4\rightarrow4MgSO_4+H_2S+4H_2O\)
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.
B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.
B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường = tổng số e nhận
B 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)
6. Al + HNO3 → Al(NO3)3+ N2O + H2O.
7. FeSO4+ H2SO4+ KMnO4 → Fe2(SO4)3+ MnSO4+ K2SO4 + H2O.
8. KMnO4+ HCl → KCl + MnCl2 + Cl2+ H2O.
9. K2Cr2O7+ HCl → KCl + CrCl3+ Cl2 + H2O.
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.
B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.
B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường = tổng số e nhận
B 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)
3. Mg + H2SO4 → MgSO4 + H2S + H2O.
4. Al + HNO3 → Al(NO3)3 + NH4NO3+ H2O.
5. Fe3O4+ HNO3 → Fe(NO3)3+ N2O + H2O.
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.
B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.
B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường = tổng số e nhận
B 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)
7. FeSO4+ H2SO4+ KMnO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.
B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.
B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường = tổng số e nhận
B 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)
3. Mg + H2SO4→ MgSO4+ H2S + H2O.
4. Al + HNO3 → Al(NO3 )3+ NH4NO3 + H2O.
5. Fe3O4 + HNO3→ Fe(NO3)3 + N2O + H2O.
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.
B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.
B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường = tổng số e nhận
B 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)
8. KMnO4 + HCl→ KCl + MnCl2 + Cl2 + H2O.
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.
B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.
B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường = tổng số e nhận
B 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)
9. K2Cr2O7 + HCl→ KCl + CrCl3 + Cl2 + H2O.
B 1 . Xác định số oxi hoá các nguyên tố(thay đổi SOH). Tìm chất khử và chất oxi hóa.
B 2 . Viết các quá trình khử và quá trình oxi hóa, cân bằng mỗi quá trình.
B 3 . Xác định hệ số cân bằng sao cho: tổng số e nhường = tổng số e nhận
B 4 . Đưa hệ số cân bằng vào phương trình, tính ra hệ số các chất khác trong phương trình(kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi)
1. P + H2SO 4 → H3PO 4 + SO2 + H2O
2. S+ HNO3 → H2SO4+ NO.
3. C3H8+ HNO3→ CO2+ NO + H2O.