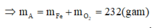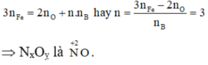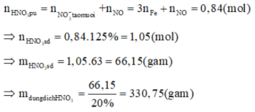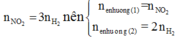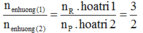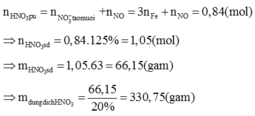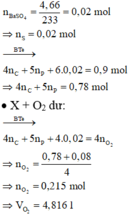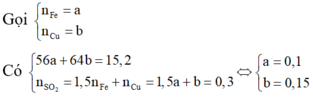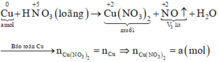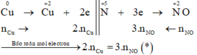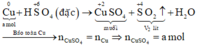Tiến hành các thí nghiệm sau: - Thí nghiệm 1: Cho a gam bột nhôm vào dung dịch H2SO4 (loãng, dư), thu được V1 lít khí không màu. - Thí nghiệm 2: Cho a gam bột nhôm vào dung dịch KOH (dư), thu được V2 lít khí không màu. - Thí nghiệm 3: Cho a gam bột nhôm vào dung dịch HNO3 (loãng, dư), thu được V3 lít khí không màu (hóa nâu trong không khí, sản phẩm khử duy nhất của N+5). Biết các phản ứng xảy ra hoàn toàn, thể tích các khí đo ở cùng đktc. So sánh nào sau đây đúng? A. V1 V2 V3...
Đọc tiếp
Tiến hành các thí nghiệm sau:
- Thí nghiệm 1: Cho a gam bột nhôm vào dung dịch H2SO4 (loãng, dư), thu được V1 lít khí không màu.
- Thí nghiệm 2: Cho a gam bột nhôm vào dung dịch KOH (dư), thu được V2 lít khí không màu.
- Thí nghiệm 3: Cho a gam bột nhôm vào dung dịch HNO3 (loãng, dư), thu được V3 lít khí không màu (hóa nâu trong không khí, sản phẩm khử duy nhất của N+5).
Biết các phản ứng xảy ra hoàn toàn, thể tích các khí đo ở cùng đktc. So sánh nào sau đây đúng?
A. V1 = V2 = V3
B. V1 > V2 > V3.
C. V3 < V1 < V2
D. V1 = V2 > V3