Nếu thể tích của một lượng khí giảm đi 1/10, áp suất tăng 1/5 và nhiệt độ tăng thêm 160C so với ban đầu. Tính nhiệt độ ban đầu của khí.
A. 300 K
B. 216 K
C. 200 K
D. 289 K
Nếu thể tích của một lượng khí giảm đi 1/5 lần , áp suất tăng thêm 1/3 lần và nhiệt độ tăng thêm 300C so với ban đầu.
a. Viết phương trình trạng tháiTính nhiệt độ ban đầu của lượng khí trên?
Đun nóng đẳng tích một lượng khí tăng thên 80 ° K thì áp suất tăng thêm 25% so với áp suất ban đầu. Tìm nhiệt độ ban đầu của khối khí.
Nhiệt độ ban đầu của một khối khí xác định có giá trị là bao nhiêu? Biết rằng khi nhiệt độ tăng thêm 16 ° C thì thể tích khí giảm đi 10% so với thể tích ban đầu, áp suất thì tăng thêm 20% so với áp suất ban đầu.
A. 200K
B. 100 ° C
C. 250K
D. −150 ° C
Đáp án: A
Ta có:
- Trạng thái 1: p 1 ; V 1 ; T 1
- Trạng thái 2: p 2 = p 1 + 0,2 p 1 = 1,2 p 1 V 2 = V 1 − 0,1 V 1 = 0,9 V 1 T 2 = T 1 + 16
Áp dụng phương trình trạng thái của khí lý tưởng, ta có:
p 1 V 1 T 1 = p 2 V 2 T 2 ↔ p 1 V 1 T 1 = 1,2 p 1 .0,9 V 1 T 1 + 16 → T 1 = 200 K
Nếu áp suất của một lượng khí tăng thêm 2.105Pa thì thể tích giảm 3 lít. Nếu áp suất tăng thêm 5.105Pa thì thể tích giảm 5 lít. Tìm áp suất và thể tích ban đầu của khí, biết nhiệt độ khí không đổi.
Ta có p 2 = p 1 + 2.10 5 ; V 2 = V 1 − 3
⇒ p 1 V 1 = p 2 V 2 ⇒ p 1 V 1 = ( p 1 + 2.10 5 ) ( V 1 − 3 ) ( 1 )
Ta có p 2 / = p 1 + 5.10 5 ; V 2 / = V 1 − 5
⇒ p 1 V 1 = p ' 2 V ' 2 ⇒ p 1 V 1 = ( p 1 + 5.10 5 ) ( V 1 − 5 ) ( 2 )
Giải hệ phương trình ( 1 ) và ( 2 ) p1 = 4.105 Pa ; V1 = 9 lít
Nếu áp suất của một lượng khí tăng thêm 2.105Pa thì thể tích giảm 3 lít. Nếu áp suất tăng thêm 5.105Pa thì thể tích giảm 5 lít. Tìm áp suất và thể tích ban đầu của khí, biết nhiệt độ khí không đổi.
A. 105Pa; 101.
B. 2.105Pa; 101.
C. 4.105Pa; 31.
D. 4.105Pa; 31
Đáp án D.
![]()
![]()
![]()
![]()
Từ 2 pt trên => p1 =4.105Pa; V1=9 lít
Nếu áp suất của một lượng khí tăng thêm 2. 10 5 Pa thì thể tích giảm 3 lít. Nếu áp suất tăng thêm 5. 10 5 Pa thì thể tích giảm 5 lít. Tìm áp suất và thể tích ban đầu của khí, biết nhiệt độ khí không đổi.
Nếu áp suất của một lượng khí tăng 2.105 Pa thì thể tích của nó giảm 3 lít, nếu áp suất tăng 5.105Pa thì thể tích giảm đi 5 lít. Coi rằng nhiệt độ của khối khí là không thay đổi, áp suất và thể tích ban đầu của khí.
A. ![]()
B. ![]()
C. ![]()
D. ![]()
Đáp án A
Gọi P0 và V0 là áp suất và thể tích ban đầu của khối khí. Gọi P1 và V1 là áp suất và thể tích của khối khí áp suất của nó tăng lên 3.105Pa
P1 =P0 + 2.105Pa; V1 = V0 - 3 lít
Vì nhiệt độ là không đổi, do đó áp dụng định luật Bôi-lơ-ma-ri-ốt, ta có:P0V0 = (P0 + 2.105)(V0 - 3)
⟹ P0V0 = P0V0 + 2.105V0 - 3V0 - 6.105
⟹ 3P0 = 2.105(V0 - 3)
Gọi P2 và V2 là áp suất và thể tích của khối khí khi áp suất của nó tăng lên 5.105Pa
⟹P1=P0+5.105Pa; V1=V0-5
Tương tự như trên, ta suy ra được:
5P0 = 5.105(V0 - 5)
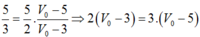 (2)
(2)
Từ (1) và (2) ta có:
⟹V0 = 15-6 = 9 lít
Thay V0=9 lít và phương trình (1), ta tìm được P0 = 4.105Pa
Người ta biến đổi trạng thái một lượng khí lý tưởng không đổi sao cho áp suất khí tăng thêm một lượng bằng 20% áp suất bạn đầu, thể tích khí giảm 1,5 lần thì nhiệt độ khí giảm đi 800C. Nhiệt độ ban đầu của khí bằng?
Một bình chứa 1 lượng khí ở nhiệt độ 30ºC và áp suất là 2.10^5 pa. Biết thể tích khí không đổi a) Hỏi phải tăng nhiệt độ lên đến bao nhiêu độ ( K ) để áp suất tăng gấp đôi b) Hỏi nếu giảm nhiệt độ xuống bao nhiêu độ C để áp suất giảm còn một nữa giúp với ạ :>
\(a,\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\Rightarrow T_2=\dfrac{T_1p_2}{p_1}=\dfrac{303.4.10^5}{2.10^5}=606^oK\\ b,T_2=\dfrac{303.10^5}{2.10^5}=151,5^oK\)