Anion Y 2 - do 5 nguyên tử của 2 nguyên tố hóa học A, B tạo nên. Tổng số electron trong Y 2 - là 50. Hai nguyên tố A, B là
A. C và O
B. C và N
C. O và Cl
D. O và S
Câu 1. Hợp chất A được tạo thành từ cation X+ và anion Y2-. Mỗi ion đều do 5 nguyên tử của hai nguyên tố tạo nên. Tổng số proton trong X+ là 11, tổng số electron trong Y2- là 50. Biết rằng hai nguyên tố trong Y2- đều thuộc cùng một nhóm A và thuộc hai chu kì liên tiếp. Phân tử khối của A là
Cation X + do 5 nguyên tử của 2 nguyên tố hóa học A, B tạo nên. Tổng số proton trong X + là 11. Hai nguyên tố A, B là
A. Li và C
B. Be và N
C. H và C
D. H và N
Chọn D

=> Có 1 nguyên tố có số proton nhỏ hơn 2,2. Nguyên tố này phải có khả năng tạo hợp chất nên nguyên tố đó là H.
Nguyên tố còn lại là N (Z=7). Ion là N H 4 +
Hợp chất A được tạo thành từ cation X + và anion Y 2 - . Mỗi ion đều do 5 nguyên tử của hai nguyên tố tạo nên. Tổng số proton trong X + là 11, tổng số electron trong Y 2 - là 50. Biết rằng hai nguyên tố trong Y 2 - đều thuộc cùng một nhóm A và thuộc hai chu kì liên tiếp. Phân tử khối của A là
A. 96
B. 78
C. 114
D. 132
D
Xét ion X + : có 5 nguyên tử, tổng số proton là 11. Vậy số proton trung bình là 2,2.
=> Có 1 nguyên tử có số proton nhỏ hoặc bằng 2 và tạo thành hợp chất. Vậy nguyên tử đó là H

Số electron trung bình của các nguyên tử trong Y 2 - là 9,6
=> Có 1 nguyên tử có số electron nhỏ hơn 9,6
=> Nguyên tử của nguyên tố thuộc chu kì 2.
=> Nguyên tử của nguyên tố còn lại thuộc chu kì 3.
Nếu 2 nguyên tố cùng thuộc một nhóm A thì sẽ hơn kém nhau 8 electron

Cho hợp chất XY2 có tổng số electron trong phân tử là 54; trong đó số electron của cation X2+ ít hơn số electron của anion Y- là 18. Vị trí của X và Y trong Bảng tuần hoàn các nguyên tố hóa học là
Hợp chất M được cấu tạo từ anion Y2- và cation X+. Mỗi ion đều do 5 nguyên tử của 2 nguyên tố tạo thành. Tổng số proton trong X+ là 11, còn tổng số electron trong Y2- là 50. Công thức phân tử của hợp chất M là:
A. (NH4)2CrO4
B. (NH4)2S2O3
C. (NH4)2HPO3
D. (NH4)2SO4
Theo 4 đáp án X+ là NH4+
ion Y 2- có tổng số e là 50 và do 2 nguyên tố tạo thành.
♦ Đáp án A: tổng số e: 24+8.4+2=58 → loại
♦ Đáp án B: tổng số e: 16.2+8.3+2=58 → Loại
♦ Đáp án C: loại do có 3 chất tạo thành
♦ Đáp án D: tổng số e: 16+8.4+2=50 → thỏa mãn
Đáp án D
Hợp chất Z được tạo nên từ cation X+ và anion Y-, mỗi ion đều do 5 nguyên tử của 2 nguyên tố phi kim tạo nên. Biết tổng số proton trong X+ là 11 và trong Y- là 47. Hai nguyên tố trong Y3- thuộc 2 chu kỳ kế tiếp nhau trong bảng tuần hoàn và có số thứ tự cách nhau 7 đơn vị. Phát biểu nào sau đây về hợp chất M là sai:
A. Phân tử khối của Z là 1 số lẻ
B. Trong hợp chất Z chỉ chứa hai loại liên kết ion và liên kết cộng hóa trị
C. Z phản ứng được với dung dịch NaOH
D. Hợp chất Z phản ứng được với dung dịch AgNO3 tạo kết tủa màu trắng
Tìm cation X+: Ta sẽ làm một bài hóa nhỏ: “Hợp chất X do 5 nguyên tố phi kim loại tạo nên, biết rằng tổng số proton trong X là 11. Tìm X”
+ Để cho dữ liệu gồm tổng số proton và tổng số nguyên tố tạo nên vì vậy ta sẽ nghĩ ngay đến trị số proton trung bình từ đó ta có: Z ¯ = 11 5 = 2 , 2 ⇒ Phải có 1 nguyên tố có số proton bé hơn 2 Chỉ có thể là H (do He là khí hiếm)
Gọi X là AHy theo giả thiết ta có:
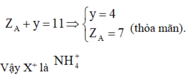
Tìm anion Y3- : Tương tự ta cũng sẽ làm bài hóa nhỏ sau: “Hợp chất Y do 5 nguyên tố phi kim thuộc 2 chu kỳ kế tiếp trong bảng tuần hoàn và có số thứ tự cách nhau 7 đơn vị tạo nên. Biết rằng tổng số proton trong Y là 47. Tìm Y”
Tương tự chúng ta cũng sẽ khai thác trị số proton trung bình:
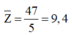
Do đó phải có 1 nguyên tố có số proton nhỏ hơn 9,4 (chu kỳ 2 hoặc 1).
Mặt khác theo giả thiết ta có 2 nguyên tố phi kim tạo nên Y thuộc 2 chu kỳ liên tiếp
=> Hai nguyên tố đó thuộc chu kỳ 2 và chu kỳ 3.
Chu kỳ 3 có các phi kim Si(14); P(15); S(16); 17 (Cl)
Từ đó ta suy ra được các cặp là (Si – N); (P – O); (S – F).
Dễ dàng nhận thấy cặp thỏa mãn là (P – O) với ion P O 4 3 -
Vậy Z là (NH4)3PO4 từ đó ta có:
A: Đúng: Phân tử khối của Z là 133
B: Đúng: Trong Z chỉ chứa liên kết ion (giữa và ) và liên kết cộng hóa trị (giữa N và H; giữa P và O)
C: Đúng: Z chứa ion nên Z phản ứng được với NaOH theo phương trình
![]()
D: Sai: Z phản ứng được với AgNO3 tạo kết tủa Ag3PO4 (màu vàng)
Đáp án D.
Cation X2+, nguyên tử Y và anion Z- đều có cấu hình electron lớp ngoài cùng là 2s22p6.
a) Viết cấu hình electron của các nguyên tử X, Y, Z.
b) Xác định vị trí của X, Y, Z trong bảng tuần hoàn các nguyên tố hóa học. Giải thích.
Cation X+ do 5 nguyên tử của 2 nguyên tố hóa học tạo nên. Tổng số proton trong X+là 11. Công thức của X+ là:
A. NH4+
B. NH3Cl+
C. Al(OH)4-
D. Ba(OH)4+
D. Ba(OH)4+
Đáp án A.
Số proton trung bình của một hạt nhân nguyên tử trong X+ là 11/5= 2,2. Vậy một nguyên tố trong X+ có điện tích hạt nhân nhỏ hơn 2,2, nguyên tố đó là H (Z = 1). Loại trường hợp He (Z = 2) vì He là khí hiếm không tạo được hợp chất. Vậy công thức ion X+có dạng: [A5-nHn]+. Trong đó : (5-n).ZA+ n = 11.Ta lập bảng sau:
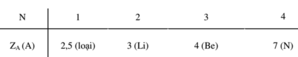
Ta loại các trường hợp A là Li, Be vì các ion X+ tương ứng không tồn tại.
Trường hợp A là nitơ thỏa mãn vì ion amoni tồn tại. Vậy X+là ion NH4+
Câu 1: Cho biết tổng số hạt proton, nơtron, electron tạo nên nguyên tử của một nguyên tố bằng 49. Trong đó số hạt không mang điện là 17.
Tính số p, e trong nguyên tử, viết tên, kí hiệu hóa học và nguyên tử khối của nguyên tố.
Câu 2: Biết 1đvC = 1u= 1,6605.10-24g. Tính khối lượng của các nguyên tử Fe, O ra gam.