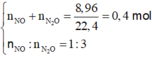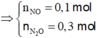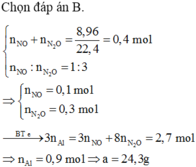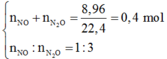cho m gam Al tan hoàn toàn trong dung dịch HNO3 thu được 44.8 lít hỗn hợp 3 khí gồm NO, N2O và N2 (đkc) có tỉ lệ mol: nNO : nN2 : nN2O= 1:2:3. Xác định giá trị m??

Những câu hỏi liên quan
Hòa tan hoàn toàn a gam bột Al vào dung dịch HNO3 dư thu được 8,96 lít (đktc) gồm hỗn hợp hai khí NO và N2O có tỉ lệ số mol là 1: 3. Giá trị của a là
A. 32,4
B. 24,3
C. 15,3
D. 29,7
Hòa tan hoàn toàn a gam bột Al vào dung dịch HNO3 dư thu được 8,96 lít (đktc) gồm hỗn hợp hai khí NO và N2O có tỉ lệ số mol là 1: 3. Giá trị của a là
A. 32,4
B. 24,3
C. 15,3
D. 29,7
Hòa tan hoàn toàn a gam bột Al vào dung dịch HNO3 dư thu được 8,96 lít (đktc) gồm hỗn hợp hai khí NO và N2O có tỉ lệ số mol là 1: 3. Giá trị của a là
A. 32,4
B. 24,3
C. 15,3
D. 29,7
Hòa tan 10,71 gam hỗn hợp gồm Al, Fe, Zn trong 4 lít dung dịch HNO3 x (M) vừa đủ thu được dung dịch A và 1,792 lít hỗn hợp khí gồm N2,N2O có tỉ lệ mol 1: 1. Cô cạn dung dịch A thu được m(gam) muối khan. Giá trị của m (gam) và x (M) là
n N2O = n N2 = 1,792/44,8 = 0,04 mol
--> m muối = 10,71 + 0,04 x 10 x 62 + 0,04 x 8 x 62 = 55,35 gam.
n HNO3 = 0,04 x 12 + 0,04 x 10 = 0,88 mol
--> Cm HNO3 = 0,88/4 = 0,22 M.
Đúng 0
Bình luận (0)
nN2=nN2O=0,04 mol⇒nNO3 muoi=10nN2+8nN2O=0,72 mol⇒mmuoi=mKL+mNO3 muoi=55,35 gnHNO3=4a=12nN2+10nN2O=0,88⇒a=0,22
M
Đúng 0
Bình luận (0)
Hỗn hợp A gồm Fe, Cu, Al, Mg (có tỉ lệ mol tương ứng là 1 : 1 : 2 : 2). Hoà tan 22,2 gam hỗn hợp A cần vừa đủ 950ml dung dịch HNO3 2M sau các phản ứng hoàn toàn thu được dung dịch X và V lit (đktc) hỗn hợp khí Y gồm 4 khí N2, NO, N2O, NO2 trong đó 2 khí N2 và NO2 có số mol bằng nhau. Cô cạn rất cẩn thận dung dịch X thu được 117,2 gam muối khan. Giá trị V là: A. 8,86 B. 6,72 C. 7,84 D. 5,04
Đọc tiếp
Hỗn hợp A gồm Fe, Cu, Al, Mg (có tỉ lệ mol tương ứng là 1 : 1 : 2 : 2). Hoà tan 22,2 gam hỗn hợp A cần vừa đủ 950ml dung dịch HNO3 2M sau các phản ứng hoàn toàn thu được dung dịch X và V lit (đktc) hỗn hợp khí Y gồm 4 khí N2, NO, N2O, NO2 trong đó 2 khí N2 và NO2 có số mol bằng nhau. Cô cạn rất cẩn thận dung dịch X thu được 117,2 gam muối khan. Giá trị V là:
A. 8,86
B. 6,72
C. 7,84
D. 5,04
Đáp án : D
Ta có : nFe : nCu : nAl : nMg =1 : 1 : 2 : 2
=> nFe = nCu = 0,1 ; nAl = nMg = 0,2 mol
4 khí trong đó N2 và NO2 có số mol bằng nhau
=> có thể qui về N2O và NO với số mol lần lượt là x và y
n N O 3 m u ố i K L = ne KL = 3nFe + 2nCu + 3nAl + 2nMg = 1,5 mol
=> mmuối = mKL + m N O 3 m u ố i K L + m N H 4 N O 3
=> n N H 4 N O 3 = 0,025 mol
Bảo toàn N :
2 n N 2 O + n N O + 2 n N H 4 N O 3 + n N O 3 m u ố i K L = n H N O 3
=> 2x + y = 0,35 mol
Bảo toàn e :
2 n N 2 O + n N O + 2 n N H 4 N O 3 + n N O 3 m u ố i K L = n H N O 3
=> 8x + 3y = 1,3
=> x = 0,125 ; y = 0,1 mol
=> V = 5,04 lit
Đúng 0
Bình luận (0)
Cho m(g) Al tan hoàn toàn trong dung dịch
HNO
3
thấy tạo ra 11,2 lít (đktc) hỗn hợp 3 khí NO,
N
2
O
,
N
2
với tỷ lệ mol tương ứng là 1: 2 : 2. Giá trị của m là A. 16,47g. B. 23g. C. 35,1g. D. 12,73g.
Đọc tiếp
Cho m(g) Al tan hoàn toàn trong dung dịch HNO 3 thấy tạo ra 11,2 lít (đktc) hỗn hợp 3 khí NO, N 2 O , N 2 với tỷ lệ mol tương ứng là 1: 2 : 2. Giá trị của m là
A. 16,47g.
B. 23g.
C. 35,1g.
D. 12,73g.
Chọn C
Gọi số mol của NO là a mol → số mol của N 2 O là 2a mol; số mol N 2 là 2a mol.
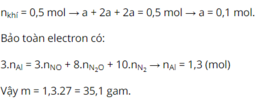
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 100 gam hỗn hợp X gồm Fe, Cu, Ag trong dung dịch HNO3 (dư). Kết thúc phản ứng thu được 13,44 lít (đktc) hỗn hợp khí Y gồm NO2, NO, N2O theo tỉ lệ mol tương ứng là 3:2:1 và dung dịch Z (không chứa NH4NO3). Cô cạn dung dịch Z thu được m gam muối khan. Giá trị của m và số mol HNO3 đã phản ứng lần lượt là A. 199,2 gam và 2,4 mol B. 199,2 gam và 2,5 mol C. 205,4 gam và 2,4 mol D. 205,4 gam và 2,5 mol
Đọc tiếp
Hòa tan hoàn toàn 100 gam hỗn hợp X gồm Fe, Cu, Ag trong dung dịch HNO3 (dư). Kết thúc phản ứng thu được 13,44 lít (đktc) hỗn hợp khí Y gồm NO2, NO, N2O theo tỉ lệ mol tương ứng là 3:2:1 và dung dịch Z (không chứa NH4NO3). Cô cạn dung dịch Z thu được m gam muối khan. Giá trị của m và số mol HNO3 đã phản ứng lần lượt là
A. 199,2 gam và 2,4 mol
B. 199,2 gam và 2,5 mol
C. 205,4 gam và 2,4 mol
D. 205,4 gam và 2,5 mol
Đáp án C
Ta có nN2O = 0,1 mol; nNO = 0,2 mol và nNO2 = 0,3 mol
Có mmuối = mkl + mNO3- = 100 + 62. ( 0,1. 8 + 0,2. 3+ 0,3) = 205,4 gam
Có nHNO3 pư = 0,1.10 + 0,2. 4 + 0.3.2 = 2,4 mol
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 100 gam hỗn hợp X gồm Fe, Cu , Ag trong dung dịch
HNO
3
(dư). Kết thúc phản ứng thu được 13,44 lít hỗn hợp khí Y gồm
NO
2
, NO,
N
2
O
theo tỉ lệ số mol tương ứng là 3 : 2 : 1 và dung dịch Z (không chứa muối
NH
4
NO
3
). Cô cạn dung dịch Z thu được m gam muối kha...
Đọc tiếp
Hòa tan hoàn toàn 100 gam hỗn hợp X gồm Fe, Cu , Ag trong dung dịch HNO 3 (dư). Kết thúc phản ứng thu được 13,44 lít hỗn hợp khí Y gồm NO 2 , NO, N 2 O theo tỉ lệ số mol tương ứng là 3 : 2 : 1 và dung dịch Z (không chứa muối NH 4 NO 3 ). Cô cạn dung dịch Z thu được m gam muối khan. Giá trị của m và số mol HNO 3 đã phản ứng lần lượt là:
A. 205,4 gam và 2,5 mol
B. 199,2 gam và 2,4 mol
C. 205,4 gam và 2,4 mol
D. 199,2 gam và 2,5 mol
Hòa tan hoàn toàn 100 gam hỗn hợp X gồm Fe, Cu, Ag trong dung dịch
H
N
O
3
(dư). Kết thúc phản ứng thu được 13,44 lít (đktc) hỗn hợp khí Y gồm NO2, NO, N2O theo tỉ lệ số mol tương ứng là 3 : 2 : 1 và dung dịch Z (không chứa muối NH4NO3). Cô cạn dung dịch Z thu được m gam muối khan. Giá trị của m và số mol HNO3 đã phản ứng lần lượt là A. 205,4 gam và 2,3 mol B. 199,2 gam và 2,4 mol C. 205,4 gam và 2,4 mol D. 199,2 gam và 2,3 mol
Đọc tiếp
Hòa tan hoàn toàn 100 gam hỗn hợp X gồm Fe, Cu, Ag trong dung dịch H N O 3 (dư). Kết thúc phản ứng thu được 13,44 lít (đktc) hỗn hợp khí Y gồm NO2, NO, N2O theo tỉ lệ số mol tương ứng là 3 : 2 : 1 và dung dịch Z (không chứa muối NH4NO3). Cô cạn dung dịch Z thu được m gam muối khan. Giá trị của m và số mol HNO3 đã phản ứng lần lượt là
A. 205,4 gam và 2,3 mol
B. 199,2 gam và 2,4 mol
C. 205,4 gam và 2,4 mol
D. 199,2 gam và 2,3 mol