Với phân tử Octatetraene, hãy xác định số sóng (cm-1) của ánh sáng cần thiết để kích thích 1 electron từ mức năng lượng cao nhất có electron (HOMO) lên mức năng lượng thấp nhất không có electron (LUMO).
Mức năng lượng trong nguyên tử hiđrô được xác định bằng biểu thức E = - 13,6/n² (eV) trạng thái cơ bản ứng với n = 1. Một đám khí hiđrô đang ở trạng thái kích thích và electron đang ở quĩ đạo dừng N. Tỉ số giữa bước sóng dài nhất và ngắn nhất mà đám khí trên có thể phát ra khi chuyển về trạng thái dừng có mức năng lượng thấp hơn là:
A. 16/9
B. 192/7
C. 135/7
D. 4
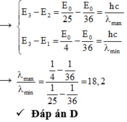
Nguyên tử hydro ở trạng thái dừng có mức năng lượng thứ n tuân theo công thức E n = − E 0 n 2 e V . Nguyên tử đang ở trạng thái kích thích thứ nhất. Kích thích nguyên tử đến trạng thái mà động năng của electron giảm đi 9 lần. Tỉ số giữa bước sóng lớn nhất và bước sóng ánh sáng nhìn thấy nhỏ nhất mà nguyên tử này có thể phát ra gần đúng bằng
A. 33,4
B. 0,0023
C. 0,055
D. 18,2
+ Vận tốc của electron khi nó chuyển động trên quỹ đạo thứ n: v ~ 1 n
→ Động năng giảm 9 lần → v giảm 3 lần → n = 6.
+ Bước sóng dài nhất ứng với sự chuyển mức năng lượng từ E6 về E5, bước sóng nhìn thấy ngắn nhất ứng với sự chuyển mức năng lượng từ E6 về E2.
Khi phóng tia lửa điện qua các nguyên tử hydrogen ở áp suất thấp, các electron bị kích thích lêntrạng thái năng lượng cao hơn. Sau đó, electron nhanh chóng chuyển về mức năng lượng cơ bản (n = 1) và bức xạ ra photon với các bước sóng khác nhau tạo thành dãy phổ. Tính bước sóng (λ, nm) nhỏ nhất và bước sóng lớn nhất theo nm của dãy phổ nếu electron chuyển từ n > 1 về n = 1.
\(\lambda_{max}=\dfrac{hc}{13,6\left(\dfrac{1}{1}-\dfrac{1}{2^2}\right)eV\cdot1,602\cdot10^{-19}J\cdot eV^{-1}}m\cdot10^9nm\cdot m^{-1}=121,56nm\\ \lambda_{min}=\dfrac{hc}{13,6\left(\dfrac{1}{1}-\dfrac{1}{n_{\infty}^2}\right)eV\cdot1,602\cdot10^{-19}J\cdot eV^{-1}}m\cdot10^9nm\cdot m^{-1}=91,17nm\)
Electron trong nguyên tử hiđrô chuyển mức năng lượng, nguyên tử bức xạ một phôtôn ánh sáng có bước sóng . Độ biến thiên năng lượng của nguyên tử:
A. tăng 10,2 eV
B. giảm 10,2 eV
C. tăng 162 , 9 . 10 - 20 e V
D. giảm 162 , 9 . 10 - 20 e V
Hãy viết cấu hình electron của nguyên tử S (Z=16). Cho biết:
a, Nguyên tử lưu huỳnh có bao nhiêu lớp electron, mỗi lớp có bao nhiêu electron?
b, Phân lớp electron nào có mức năng lượng cao nhất?
Cấu hình electron của nguyên tử S (Z=16) : \(1s^22s^22p^63s^23p^4\)
a) Nguyên tử lưu huỳnh có 3 lớp electron
+ Lớp thứ nhất : 2e
+ Lớp thứ hai : 8e
+ Lớp thứ 3 : 6e
b) Phân lớp cuối cùng chứa mức năng lượng cao nhất : 3p
Trong nguyên tử X, lớp electron có mức năng lượng cao nhất là M. Ở lớp M, phân lớp p có 4 electron. Số electron của nguyên tố X là
A. 6
B. 16
C. 18
D. 14
Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là :
A. khí hiếm và kim loại.
B. phi kim và kim loại.
C. kim loại và khí hiếm.
D. kim loại và kim loại.
Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là
A. kim loại và kim loại.
B. kim loại và khí hiếm.
C. phi kim và kim loại.
D. khí hiếm và kim loại.
Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là
A. kim loại và kim loại
B. phi kim và kim loại
C. kim loại và khí hiếm
D. khí hiếm và kim loại