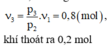Một bình chứa khí ờ nhiệt độ 27 ° C và áp suất 40atm. Hỏi khi một nửa lượng khí thoát ra ngoài thì áp suất của nó còn lại trong bình là bao nhiêu? Biết nhiệt độ của bình khi đó là 12 ° C.

Những câu hỏi liên quan
Một bình chứa khí ở nhiệt độ 270C và áp suất 40atm. Hỏi khi một nửa lượng khí thoát ra ngoài thì áp suất của nó còn lại trong bình là bao nhiêu? Biết nhiệt độ của bình khi đó là 120C
Khi khí chưa thoát ra ngoài ta có: p 1 V 1 = m 1 μ R T 1 (1)
Khi một nửa lượng khí đã thoát ra ngoài ta có:
p 2 V 2 = m 2 μ R T 2 với V1 và m 2 = m 1 2 ⇒ p 2 V 1 = m 1 2 μ R T 2
Từ (1) và (2) ⇒ p 2 = p 1 T 2 2 T 1 = 40.285 2.300 = 19 a t m
Đúng 0
Bình luận (0)
Một bình chứa một lượng khí ở nhiệt độ 27 ° C và áp suất 40 atm. Nếu giảm nhiệt độ xuống tới 12C và để một nửa lượng khí thoát ra ngoài thì áp suất khí còn lại trong bình sẽ bằng bao nhiêu ?
Xét lượng khí còn lại trong bình
Trạng thái 1: V 1 = V/2; T 1 = 27 + 273 = 300 K; p 1 = 40 atm.
Trạng thái 2: V 2 = V; T 2 = 12 + 273 = 285 K; p 2 = ? atm,
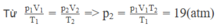
Đúng 0
Bình luận (0)
Một bình kín chứa 1 mol khí Nito, áp suất 10 5 Pa, ở nhiệt độ 27 ° C . Do có một lượng khí thoát ra ngoài nên áp suất của khí trong bình chỉ còn 0,8. 10 5 Pa, nhiệt độ vẫn được giữ không đổi. Lượng khí đã thoát ra ngoài bằng:
A. 0,4mol
B. 0,8mol
C. 0,2mol
D. 0,1mol
Đáp án: C
Ban đầu, khí Nito có khối lượng mm, thể tích V, áp suất p, nhiệt độ T
PT: p 1 V = m M R T 1
- Sau một thời gian, khí Heli có khối lượng m′, thể tích V, áp suất p2, nhiệt độ T
PT: p 2 V = m ' M R T 2
Lấy 2 1 ta được:
p 2 p 1 = m ' m ↔ 0,8 1 = m ' m → m ' = 0,8 m
=> Lượng khí Nito đã thoát ra:
Δ m = m − m ' = m − 0,8 m = 0,2 m = 0,2.1.28 = 5,6 g
Số mol khí Nito thoát ra ngoài là: n = m M = 5,6 28 = 0,2 m o l
Vậy lượng khí đã thoát ra ngoài bằng: 0,2mol
Đúng 0
Bình luận (0)
Một bình thép chứa khí ở nhiệt độ 27 ° C và áp suất 40atm. Nếu tăng áp suất thêm 10atm thì nhiệt độ của khí trong binh là:
A. 102 ° C
B. 375 ° C
C. 34 ° C
D. 402 ° C
Đáp án: A
Vì thể tích của bóng đèn không đổi nên ta có:
p 1 T 1 = p 2 T 2 → T 2 = P 2 P 1 T 1 = 40 + 10 40 . ( 27 + 273 ) = 375 − 273 = 102 0 C
Đúng 0
Bình luận (0)
Một bình kín chứa 1 mol khí nitơ ở áp suất
10
5
N
/
m
2
ở
27
°
C. Khi đó van điều áp mở ra và 1 lượng khí thoát ra ngoài, nhiệt độ vẫn giữ không đổi. Sau đó áp suất giảm còn 4.
10
4
N
/...
Đọc tiếp
Một bình kín chứa 1 mol khí nitơ ở áp suất 10 5 N / m 2 ở 27 ° C. Khi đó van điều áp mở ra và 1 lượng khí thoát ra ngoài, nhiệt độ vẫn giữ không đổi. Sau đó áp suất giảm còn 4. 10 4 N / m 2 lượng khí đã thoát ra là bao nhiêu?
A. 0,8 mol
B. 0,2mol
C. 0,4 mol
D. 0,1 mol
Chọn đáp án B
? Lời giải:
+ Do V, T không đổi nên ta có:
v 3 = p 3 p 2 . v 1 = 0 , 8 mol
khí thoát ra 0,2 mol.
Đúng 0
Bình luận (0)
Một bình kín chứa 1 mol khí nitơ ở áp suất
10
5
N
/
m
2
ở
27
°
C
Khi đó van điều áp mở ra và 1 lượng khí thoát ra ngoài , nhiệt độ vẫn giữ không đổi. Sau đó áp suất giảm còn
4
.
10
4
N
/
m...
Đọc tiếp
Một bình kín chứa 1 mol khí nitơ ở áp suất 10 5 N / m 2 ở 27 ° C
Khi đó van điều áp mở ra và 1 lượng khí thoát ra ngoài , nhiệt độ vẫn giữ không đổi. Sau đó áp suất giảm còn 4 . 10 4 N / m 2 lượng khí đã thoát ra là bao nhiêu?
A. 0,8 mol
B. 0,2mol
C. 0,4 mol
D. 0,1 mol
Một lượng khí H 2 đựng trong một bình có thế tích 2 lít ở áp suất l,5atm, nhiệt độ là 27 ° C. Đun nóng khí đến nhiệt độ 127 ° C do bình hở nên một nửa lượng khí thoát ra ngoài. Tính áp suất khí trong bình.
+ Gọi v 0 là thể tích của bình
Ta xét trạng thái của lượng khí còn lại trong bình sau khi nhiệt độ tăng lên 127 độ C. Khi đó nó chiếm thể tích cả binh nhưng khi chưa mả van và nhiệt độ trong binh còn 27 độ C thì nó chiếm một phần hai thể tích cả bình.
Khi lượng khí đó ở nhiệt độ 27 ° C trạng thái 1

Đúng 0
Bình luận (0)
Một bình chứa khí hyđrô nén, thể tích 10 lít, nhiệt độ
7
C
0
áp suất 50 atm. Khi nung nóng bình, vì bình hở nên một phần khí thoát ra ngoài; phần khí còn lại có nhiệt độ
17
C
0
còn áp suất vẫn như cũ. Tính khối lượng hyđrô đã thoát ra ngoài. A. 1,89g B. 2,32g C. 4,78g D. 1,47g
Đọc tiếp
Một bình chứa khí hyđrô nén, thể tích 10 lít, nhiệt độ 7 C 0 áp suất 50 atm. Khi nung nóng bình, vì bình hở nên một phần khí thoát ra ngoài; phần khí còn lại có nhiệt độ 17 C 0 còn áp suất vẫn như cũ. Tính khối lượng hyđrô đã thoát ra ngoài.
A. 1,89g
B. 2,32g
C. 4,78g
D. 1,47g
Chọn D.
Gọi khối lượng khí trong bình trước và sau khi nung là .
Áp dụng phương trình Cla-pê-rôn – Men-đê-lê-ép, ta có:

Suy ra độ biến thiên khối lượng khí trong bình là:
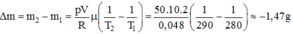
Dấu "–" cho biết khí thoát bớt ra khỏi bình.
Đúng 0
Bình luận (0)
Một bình chứa khí hyđrô nén, thể tích 10 lít, nhiệt độ 7 o C , áp suất 50atm. Khi nung nóng bình, vì bình hở nên một phần khí thoát ra ngoài; phần khí còn lại có nhiệt độ 17 o C còn áp suất vẫn như cũ. Tính khối lượng hyđrô đã thoát ra ngoài.