Câu hỏi được trích từ đề thi THPTQG năm 2017 , câu hỏi đăng lên đây không mang tính chất " thách đố " , bạn nào làm được , đúng sẽ được GP . Bổ sung thêm vào đề là : Viết các CTHH của các chất được xác định

Câu hỏi được trích từ đề thi THPTQG năm 2017 , câu hỏi đăng lên đây không mang tính chất " thách đố " , bạn nào làm được , đúng sẽ được GP . Bổ sung thêm vào đề là : Viết các CTHH của các chất được xác định

D đúng vì
Quỳ tím chuyển xanh loại A , C
Cu(OH)2 màu xanh lam loại B
PTHH :
HCOOC2H5 + 2Ag(NH3)2OH --> NH4OCOOC2H5 + 2Ag + 3NH3 + H2O
C5H11O5-CHO + 2Cu(OH)2 + NaOH --> C5H11O5-COONa + Cu2O + 3H2O
C6H5-NH2 + 3Br2 --> C6H2Br3NH2 + 3HBr.
nhớ sơ sơ pt :)) tham khảo mạng 1 cái pt khỏi cần GP cx đc :D
CTHH của lysin đây bạn
C6 H14 N2O2
Mình chỉ viết đc thế thôi còn gọn hơn thì chịu bạn à
Đáp án D nhé bạn.
Etyl fomat HCOOC2H5 tác dụng với dung dịch AgNO3 là HCOOC2H5 + 2Ag(NH3)2OH = NH4OCOOC2H5 + 2Ag + 3NH3 + H2O
Lysin (H2N-(CH2)4-CH-NH2-COOH) do có hai gốc -NH2 làm quỳ chuyển xanh
Glucozơ tác dụng với Cu(OH)2 ở nhiệt độ thường Cu(OH)2 bị hòa tan, dung dịch tạo thành có màu xanh lam: 2C6H12O6 + Cu(OH)2 = 2C6H11O6Cu + 2H2O
Anilin tác dụng với nước Brom theo phản ứng thế: C6H5NH2 + 3Br2 => C6H4Br3N
Hỗn hợp X gồm Al và kim loại M (hóa trị II).Hòa tan hoàn toàn X trong dung dịch H2SO4 đặc,nóng,dư thu được dung dịch A và khí B.Khí B hấp thụ trong dung dịch NaOH dư,tạo ra 50,4g muối.Khi thêm X một lượng kim loại M gấp đôi lượng kim loại M có sẵn trong hỗn hợp X(giữ nguyên lượng Al),thì khối lượng muối thu được tăng 32g.Còn nếu giảm 1/2 lượng Al có trong X(giữ nguyên lượng M)thì thu được 5,6 dm3 khí B(đo ở đktc)
a)Xác định kim loại M
b)tính thành phần % về m các kim loại trong hỗn hợp X
a/ \(2Al\left(x\right)+6H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3SO_2\left(1,5x\right)+6H_2O\)
\(M\left(y\right)+2H_2SO_4\rightarrow MSO_4+SO_2\left(y\right)+2H_2O\)
\(2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\)
Gọi số mol của Al và M lần lược là x, y.
\(\Rightarrow n_{SO_2}=1,5x+y\left(mol\right)\)
\(n_{Na_2SO_3}=\dfrac{50,4}{126}=0,4\left(mol\right)\)
\(\Rightarrow1,5x+y=0,4\left(1\right)\)
Nếu giảm \(\dfrac{1}{2}\) lượng Al có trong X(giữ nguyên lượng M) thì thu được 5,6 dm3 khí B(đo ở đktc).
\(\Rightarrow n_{SO_2}=\dfrac{1,5x}{2}+y=0,75x+y=\dfrac{5,6}{22,4}=0,25\left(2\right)\left(mol\right)\)
Từ (1) và (2) ta có hệ: \(\left\{{}\begin{matrix}1,5x+y=0,4\\0,75x+y=0,25\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
Khi thêm X một lượng kim loại M gấp đôi lượng kim loại M có sẵn trong hỗn hợp X(giữ nguyên lượng Al).
Số mol của SO2 tăng thêm là: \(n_{SO_2\left(tang\right)}=y=0,1\left(mol\right)\)
Khối lượng muối tăng thêm là:
\(0,1.2\left(M+96\right)=32\)
\(\Leftrightarrow M=64\)
b/ Câu này đơn giản e tự làm nhé.
PS: Anh có 1 số nhận xét về cái đề của e như sau:
1/ Cho 2 kim loại đó vào H2SO4 đặc nóng thì nó có thể cho sản phẩm là SO2; H2S hoặc hỗn hợp 2 khí trên nên chỉ bảo tạo khí B thì phải chia trường hợp mới giải được. Nhưng đề cỡ đó thì cỡ e chưa học đâu nên có thể là sai sót trong ra đề nên a mặc định khí B là khí SO2 duy nhất.
2/ Khi cho vào lượng gấp 2 M thì khối lượng muối tăng 32g. Đoạn này là thiếu, muối tăng là muối trong phản ứng với H2SO4 hay với NaOH hay là muối trong cả 2 cái đó. A mặc định là muối trong axit nhé.
Gọi nAl = a
n M = b
2Al + 6H2SO4 -->3SO2 + 6H20 + Al2(SO4)3 (1)
a............................1,5a
M + 2H2SO4--> MSO4 + SO2 + 2H20
b...................................b
nNa2SO3 = 50,4 / 126 = 0,4
SO2 + 2NaOH --> Na2S03 + H20
0,4.......................0,4
=> n S02 = 1,5a + b = 0,4 (*)
Nếu giảm 1/2 lượng Al thì n S02 ở pt 1 = 0,75a
nSO2 = 0,75a + b = 5,6 / 22,4 = 0,25 (**)
Từ (*) và (**)
=> a = 0,2
b = 0,1
Khi thêm vào X một lượng kim loại M gấp đôi lượng kim loại M có sẵn trong hỗn hợp X (giữ nguyên lượng Al), thì khối lượng muối thu được tăng 32g
=> m muối tăng = 2b ( M + 96 ) = 32
mà b = 0,1
=> M = 64
M là Cu
BẢNG TỔNG HỢP ĐIỂM SAU 3 VÒNG THI CỦA CUỘC THI HÓA HỌC
|
Tên níck |
Điểm V1 |
Điểm V2 |
Điểm V3 |
Tổng |
Thứ hạng |
|
An Trịnh Hữu |
9 |
9.1 |
8 |
26.1 |
1 |
|
Rồng đỏ bảo lửa(songoku) |
9 |
9.25 |
7.8 |
26.05 |
2 |
|
Phan Lê Minh Tâm |
4.75 |
9.35 |
8.9 |
23 |
3 |
|
Lặng Lẽ |
4.8 |
8.5 |
8.5 |
21.8 |
4 |
|
Trần Hữu Tuyển |
5.2 |
7.35 |
7.5 |
20.05 |
5 |
|
Tenten |
9.35 |
9 |
18.35 |
||
|
Rain Tờ Rym Te |
8.8 |
9 |
17.8 |
||
|
Feed là quyền công dân |
8.6 |
7.5 |
16.1 |
||
|
Huỳnh Thanh Xuân |
7 |
8 |
15 |
||
|
Đỗ Nguyễn Xuân Thanh |
8.25 |
6 |
14.25 |
||
|
Azue |
4.5 |
7.2 |
11.7 |
||
|
Hoàng Tuấn Đăng |
8.5 |
8.5 |
|||
|
Nguyễn Quang Định |
7.8 |
7.8 |
|||
|
Elly Phạm |
7.75 |
7.75 |
|||
|
Trương Tuyết Nhi |
6.65 |
6.65 |
|||
|
Tài Nguyễn |
6.5 |
6.5 |
|||
|
Anh Triết |
5.8 |
5.8 |
|||
|
Phương Loan |
4.9 |
4.9 |
|||
|
Đoàn Đức Hiếu |
4.7 |
4.7 |
|||
|
Lưu Hiền |
4.5 |
4.5 |
|||
|
Lê Quỳnh Trang |
4.4 |
4.4 |
|||
|
Toshiro Kiyoshi |
4.25 |
4.25 |
|||
|
Dương Phan Khánh Dương |
2.3 |
1.8 |
4.1 |
||
|
Đức Minh |
3.75 |
3.75 |
|||
|
Mẫn Cảm |
3.7 |
3.7 |
|||
|
Vũ Đức Toàn |
3.7 |
3.7 |
|||
|
Nào Ai Biết |
3.6 |
3.6 |
|||
|
Ha Hoang Vu Nhat |
3.5 |
3.5 |
|||
|
lê thị hương giang |
2.9 |
2.9 |
|||
|
Hoàng Hải Yến |
2.55 |
2.55 |
|||
|
Phan Thùy Linh |
2.5 |
2.5 |
|||
|
Trần Dương |
2 |
2 |
|||
|
Trần Thiên Kim |
1.7 |
1.7 |
|||
|
Ngô Tấn Đạt |
1.3 |
1.3 |
|||
|
nguyen van tuan |
1 |
1 |
|||
|
Nhật Minh |
0 |
0 |
|||
|
Hồng Phúc Nguyễn |
0 |
0 |
|||
|
Đức Nhật Huỳnh |
0 |
0 |
|||
|
Nguyễn Như Quỳnh |
0 |
0 |
|||
|
MIGHFHF |
0 |
0 |
|||
|
Trần Minh Hoàng |
0 |
0 |
Bạn nào bị sai điểm thì nhắc cô nhé
Cảm ơn cô @Cẩm Vân Nguyễn Thị và bạn Rainbow tổ chức. Căn cứ kết quả như vậy, hoc24 trao giải thưởng cho các bạn như sau:
1. Giải nhất: (Thưởng 100k + 20GP)
2. Giải nhì: (Thưởng 50k + 15GP)
3. Giải ba: (Thưởng 15GP)
Chúc mừng các em đã đạt giải. Thầy sẽ liên hệ với các bạn đạt giải để trao thưởng.
Cái chỗ này là 23 chứ sao lại 233 được ạ ? Cô đánh dư mất òi ![]()

Tổng điểm 3 vòng thì xếp hạng ntn ạ cô
THÔNG BÁO VỀ CUỘC THI HÓA HỌC
Vòng 3 của cuộc thi hóa học đã chính thức khép lại. Sau đây thì cô sẽ công bố đáp án của vòng 3.
ĐÁP ÁN
Câu 1: Hoàn thành chuỗi phản ứng sau
a. S → SO2 → SO3 → H2SO4 → Na2SO4 → BaSO4
b. MnO2 → Cl2 → HCl → NaCl → NaOH → NaClO
a. (1) S + O2 \(\underrightarrow{t^o}\)SO2
(2) 2SO2 + O2 \(\underrightarrow{t^o,p,V_2O_5}\) 2SO3
(3) SO3 + H2O → H2SO4
(4) H2SO4 + NaOH → Na2SO4 + H2O
(5) Na2SO4 + Ba(OH)2 → BaSO4↓ + 2NaOH
b. (1) MnO2 + 4HCl đặc 2\(\underrightarrow{t^o}\)MnCl2 + Cl2↑ + 2H2O
(2) Cl2 + H2 \(\underrightarrow{t^o}\)2HCl↑
(3) HCl + NaOH → NaCl + H2O
(4) 2NaCl + H2O \(\underrightarrow{đpmn}\)NaOH + H2↑ + Cl2↑
(5) 2NaOH + Cl2 → NaCl + NaClO + H2O
Câu 2: “Không khí” là một hỗn hợp chứa rất nhiều chất khí với thành phần chủ yếu là khí nitơ, oxi, cacbonic, argon,…Theo kết quả phân tích của NASA thành phần % về thể tích của các khí trong không khí là như sau:
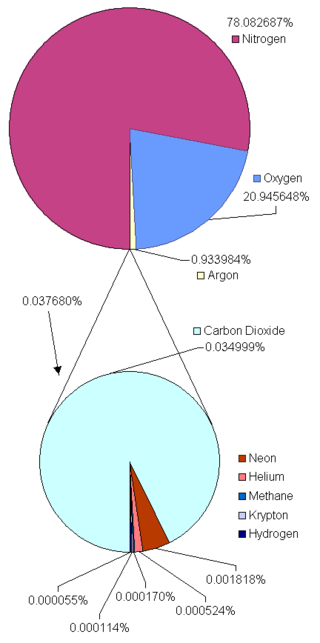 |
Nitrogen: N2 (MN2=28) Oxygen: O2 (MO2=32) Argon: Ar ( MAr=40) Carbon Dioxide: CO2 (MCO2=44) Neon: Ne Helium : He Methane: CH4 Krypton: Kr Hydrogen: H2 |
Dựa vào biểu đồ do NASA nghiên cứu, chúng ta thấy rằng, thành phần chính của không khí chủ yếu là khí nitơ, khí oxi, khí argon và khí cacbonic. Dựa vào các số liệu % về thể tích bốn khí đã cho ở trên, hãy tính gần chính xác giá trị khối lượng mol trung bình của không khí. Giải thích tại sao giá trị khối lượng mol trung bình của không khí thường được sử dụng là 29 (g/mol).
Dựa vào biểu đồ ta có thành phần % về thể tích của các khí nitơ, oxi, argon, cacbonic lần lượt là:
| Khí | N2 | O2 | Ar | CO2 |
| % | 78,082687 | 20,945648 | 0,933984 | 0,034999 |
Khối lượng mol trung bình chính xác của không khí là
\(\overline{M_{kk}}=\%N_2.28+\%O_2.32+\%Ar.40+\%CO_2.44=28,95475\)
Giá trị khối lượng mol trung bình của không khí thường được sử dụng là 29 (g/mol) vì nó rất gần với giá trị tính toán chính xác.
Câu 3: Chỉ sử dụng thuốc thử là dung dịch phenolphthalein hãy đề xuất cách nhận biết 4 dung dịch mất nhãn sau: NaOH, H2SO4, Na2SO4, BaCl2.
- Trích mẫu thử các dung dịch vào các ống nghiệm, nhỏ một giọt phenolphtalein vào mỗi ống nghiệm.
+ Dung dịch chuyển màu hồng : NaOH.
+ Dung dịch không đổi màu : H2SO4, Na2SO4, BaCl2.
- Trích mẫu thử 3 dung dịch H2SO4, Na2SO4, BaCl2 cho vào 3 ống nghiệm riêng biệt, nhỏ vào mỗi ống nghiệm một giọt phenolphtalein, sau đó cho vào mỗi ống nghiệm một giọt dung dịch NaOH.
+ Dung dịch chuyển màu hồng: Na2SO4, BaCl2.
+ Dung dịch không đổi màu : H2SO4.
2NaOH + H2SO4 → Na2SO4 + H2O
- Trích mẫu thử 2 dung dịch Na2SO4, BaCl2 vào các ống nghiệm, sau đó cho tác dụng với dung dịch H2SO4.
+ Xuất hiện kết tủa trắng : BaCl2.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
+ Không xẩy ra hiện tượng gì : Na2SO4.
Câu 4: Hòa tan 0,575g kim loại Na vào 200ml dung dịch H2SO4 0,05M thì thu được dung dịch X và V lít khí H2(đktc).
a. Xác định giá trị V và tính nồng độ mol của các chất tan có trong dung dịch X sau phản ứng. Coi như thể tích dung dịch không thay đổi sau phản ứng.
b. Nhỏ từ từ đến dư dung dịch Ba(HCO3)2 vào dung dịch X. Tính khối lượng kết tủa cực đại thu được sau phản ứng.
a. \(n_{Na}=0,025mol;n_{H2SO4}=0,02mol.\)
Vì \(\dfrac{n_{Na}}{2}>\dfrac{n_{H2SO4}}{1}\) ⇒ Sau khi phản ứng với axit, Na còn dư. Kim loại Na dư sẽ tiếp tục phản ứng với nước.
PTHH:
2Na + H2SO4 loãng → Na2SO4 + H2↑
0,02......0,01....................0,01......0,01
2Na + 2H2O → 2NaOH + H2↑
0,005....0,005.......0,005.....0,0025
\(\Rightarrow V_{H2}=22,4.\left(0,01+0,0025\right)=0,28lit\)
Sau phản ứng, coi như thể tích dung dịch không thay đổi.
\(\Rightarrow C_{M\left(Na2SO4\right)}=\dfrac{0,01}{0,2}=0,05M\)
\(\Rightarrow C_{M\left(NaOH\right)}=\dfrac{0,005}{0,2}0,025M\)
b. Khi nhỏ từ từ dung dịch Ba(HCO3)2 từ từ đến dư vào dung dịch X (gồm Na2SO4 và NaOH) xẩy ra các phản ứng như sau:
Ba(HCO3)2 + 2NaOH → BaCO3↓ + Na2CO3 + H2O
0,0025.............0,005..........0,0025........0,0025
Ba(HCO3)2 + Na2SO4 → BaSO4↓ + NaHCO3
0,01....................0,01...........0,01..........0,01
Ba(HCO3)2 + Na2CO3 → BaCO3↓ + NaHCO3
0,0025.............0,0025........0,0025........0,0025
Sau khi phản ứng hoàn toàn, kết tủa thu được gồm BaSO4 và BaCO3.
\(\Rightarrow m_{\downarrow}=m_{BaSO4}+m_{BaCO3}=3,315g\)
Câu 5: Một oxit kim loại có công thức là MxOy, trong đó M chiếm 72,41% khối lượng. Khử hoàn toàn oxit này bằng khí CO thu được 16,8g kim loại M. Hòa tan lượng 16,8g kim loại M bằng H2SO4 đặc nóng thu được muối M hóa trị III và 10,08 lít khí SO2(đktc) là sản phẩm khử duy nhất.
a.Viết các phương trình phản ứng đã xẩy ra dưới dạng tổng quát
b.Xác định công thức hóa học của oxit MxOy.
a. PTHH:
MxOy + yCO \(\underrightarrow{t^o}\) xM + yCO2↑
2M + 6H2SO4 đặc, nóng → M2(SO4)3 + 3SO2↑ + 6H2O
b.
2M + 6H2SO4 đặc, nóng → M2(SO4)3 + 3SO2↑ + 6H2O
0,3.......0,9...............................0,15...........0,45......0,9
\(\Rightarrow M_M=\dfrac{16,8}{0,3}=56\), suy ra M là Fe.
Công thức oxit là FexOy.
Vì trong oxit kim loại Fe chiếm 72,41% khối lượng nên oxi chiếm 27,59% về khối lượng.
\(\Rightarrow\left\{{}\begin{matrix}56x=72,41\%\left(56x+16y\right)\\16y=27,59\%\left(56x+16y\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=3\\y=4\end{matrix}\right.\)
Vậy oxit là Fe3O4.
HẾT.
(Không bắt buộc các bạn phải làm giống như đáp án, sử dụng cách làm khác vẫn được điểm tối đa)
P/s: Những bạn nào đã đổi tên nick trong quá trình diễn ra cuộc thi thì nhớ cmt "Tên nick cũ-Tên nick mới" để cô còn tổng hợp điểm cho các bạn. Những bạn có tổng điểm cao nhất sẽ được nhận các phần thưởng từ cuộc thi.
cô ơi cái câu 4 nH2SO4 sao bằng 0,02 được cô
THÔNG BÁO VỀ CUỘC THI HÓA HỌC
Vòng 3 của cuộc thi hóa học hiện đã được mở
Thời gian thi từ ngày 19/08 đến 22/08
Các bạn tham gia nhiệt tình vào nhé, vòng cuối cùng rồi. Chúc các em thi vui vẻ.
Sao cô không them vào Câu hỏi hay?
Không thêm vào thì sao các bạn biết mà tham gia được -_
THÔNG BÁO VỀ CUỘC THI HÓA HỌC
Cuộc thi hóa học vòng 3 do bạn Rainbow tổ chức sẽ diễn ra vào ngày 19/08 sắp tới. Cuộc thi sẽ diễn ra trong vòng 4 ngày từ 19/08 đến 22/8. Mong các bạn nhiệt tình tham gia vì đây là vòng cuối cùng rồi.
mk chúc các bn thi tốt và đạt kết quả cao
have a good test
THÔNG BÁO VỀ CUỘC THI HÓA HỌC
Sau 2 ngày mở cuộc thi thì cô chỉ mới thấy có 6 bạn nạp bài. Có lẽ đề này đã thách thức các bạn ngay từ bài đầu tiên, nên nhìn vào thấy hơi nản. Nhưng mà chỉ có bài 1 là khó nhất thôi, còn các bài sau vẫn trong tầm tay của các bạn. Để tăng số lượng bạn tham gia, cũng như tăng thời gian suy nghĩ của các bạn. Cô sẽ kéo dài cuộc thi vòng 2 thành 4 ngày. Ngày đóng vòng 2 là 6/8.
Các bạn nhớ chú ý đến thời gian đóng vòng thi để gửi bài thi đúng hạn nhé.
em thấy bài 1 là dễ nhất, bài 2 mới khó
THÔNG BÁO MỞ VÒNG 2-CUỘC THI HÓA HỌC
Hiện tại thì vòng 2 đã được mở.
Thời gian thi từ ngày 03/08 đến ngày 05/08.
Chúc các em thi tốt !!!
Các bạn không thi vòng 1 vẫn có thể tham gia được vòng 2 nhé. Thầy vừa sửa lại rồi.
Đề này so với trình độ của lớp 9 lên 10 là vừa chứ 8-9 chưa có khả năng làm hết
THÔNG BÁO VỀ CUỘC THI HÓA HỌC
Hiện nay thì vòng 1 của cuộc thi hóa học đã chính thức khép lại. Cô cảm ơn vì sự tham gia nhiệt tình của các em.
Sau đây cô sẽ có một số nhận xét chung về bài làm của các bạn.
1. Một số lỗi sai khi làm bài thường gặp phải:
- Khi viết PTHH thì cần nêu điều kiện phản ứng, kí hiệu cho các chất kết tủa, bay hơi.
- Đối với dạng bài tách chất (hoặc nhận biết) có thể viết bằng lời hoặc biểu diễn bằng sơ đồ. Sau đó cần viết các PTHH của các phản ứng đã diễn ra.
- Đối với dạng toán CO2 tác dụng với kim loại kiềm thì thường xẩy ra 2 trường hợp. Trường hợp tạo 1 muối và trường hợp tạo cả 2 muối.
- Khi giải các bài toán hóa học các em cần để ý xem chất bào phản ứng hết, chất nào còn dư. Đối với các bài 5 và 6 rất nhiều bạn đã không để ý đến việc axit còn dư lại. Vì vậy dẫn đến việc tính toán sai kết quả.
2. Lỗi trình bày:
Lỗi này chỉ xẩy ra với các bạn đăng file ảnh. Đối với các bạn vẫn có dự định viết tay và up ảnh lên thì cô sẽ nhắc nhở các bạn một số điểm như sau
- Ảnh cần phải có độ nét, dễ quan sát.
- Không nên chụp ảnh quá sát bài viết vì khi đăng lên có thể bị mất chữ.
- Xoay ảnh lại đúng chiều trước khi up.
- Sắp xếp thứ tự các ảnh hợp lí.
Mong rằng các bạn sẽ rút kinh nghiệm để tiếp tục tham gia vòng 2 tốt hơn.
Dưới đây là đáp án của vòng 1. Những bạn có cách giải khác với đáp án, nếu đúng vẫn được chấm điểm tối đa. Đối với các bài tính toán %, những bạn nào làm tròn số đều được tính là kết quả đúng. Nếu bạn nào còn thắc mắc thì có thể inbox với cô, cô sẽ giải đáp mọi thắc mắc của các bạn.
ĐÁP ÁN VÒNG 1
1. (1,5đ) Thực hiện dãy chuyển hóa sau, viết PTHH ( ghi rõ điều kiện phản ứng nếu có):
MnO2 → Cl2 → HCl → CuCl2 → Cu(OH)2 → CuO → Cu → CuSO4
(1) MnO2 + 4HCl đặc → MnCl2 + Cl2↑ + 2H2O (ĐK: to)
(2) Cl2 + H2 → 2HCl↑ (ĐK: to)
(3) 2HCl + CuO → CuCl2 + H2O (ĐK: to)
(4) CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
(5) Cu(OH)2 → CuO + H2O (ĐK: to)
(6) CuO + CO → Cu + CO2↑ (ĐK: to)
(7) Cu + 2H2SO4 đặc, nóng → CuSO4 + SO2↑ H2O
2. (1,5đ) Trình bày phương pháp tách từng chất ra khỏi hỗn hợp muối sau: NaCl, MgCl2, BaCl2.
- Cho dung dịch NaOH dư vào hỗn hợp thì MgCl2 phản ứng tạo thành kết tủa Mg(OH)2 tách ra khỏi dung dịch. Lọc thu lấy kết tủa. Cho kết tủa tác dụng với axit HCl thì thu được MgCl2.
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
Mg(OH)2 + 2HCl → MgCl2 + H2O
- Dung dịch sau phản ứng gồm NaCl, BaCl2, NaOH. Cho dung dịch Na2CO3 dư vào hỗn hơp thì thu được kết tủa BaCO3 tách ra khỏi dung dịch. Lọc thu lấy kết tủa. Cho kết tủa tác dụng với HCl thì thu được BaCl2.
BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl
BaCO3 + 2HCl → BaCl2 + H2O + CO2↑
- Dung dịch sau phản ứng gồm các chất NaCl, Na2CO3, NaOH. Cho axit HCl vào thì thu được NaCl.
NaOH + HCl → NaCl + H2O
Na2CO3 +2HCl → 2NaCl + CO2↑ + H2O
3.(1đ) Nêu hiện tượng xảy ra khi cho dung dịch Ba(HSO4)2 vào bình đựng dung dịch Na2CO3, giải thích hiện tượng và viết phương trình phản ứng minh họa.
- Hiện tượng: Xuất hiện đồng thời kết tủa trắng và bọt khí.
- PTHH: Ba(HSO4)2 + Na2CO3 → BaSO4↓ + Na2SO4 + CO2↑ + H2O
- Giải thích: Do HSO4- phân li tạo thành H+ và SO42-. H+ tác dụng với gốc CO32- thì giải phóng khí CO2; SO42- tác dụng với Ba2+ thì tạo kết tủa trắng BaSO4.
HSO4- → H+ + SO42-
2H+ + CO32- → CO2↑ + H2O
Ba2+ + SO42- → BaSO4↓
(Giải thích đơn giản hơn: Do HSO4- là một axit mạnh nên khi tác dụng với muối cacbonat thì giải phóng khí CO2. Do trong dung dịch có gốc sunfat và bari nên sẽ tạo kết tủa BaSO4.)
4.(2đ) Có 12 lít hỗn hợp khí gồm N2 và CO2, dẫn từ từ hỗn hợp trên vào 200 ml dung dịch Ca(OH)2 1,5M. Kết thúc phản ứng thu được 20 gam kết tủa. Tính % về thể tích của khí CO2 có trong hỗn hợp khí ban đầu.
nCa(OH)2=0,3 mol.
TH1: Ca(OH)2 dư: muối tạo thành là CaCO3.
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,2..........0,2...............0,2
⇒ VCO2 = 4,48 lít , VN2=7,52 lít
⇒ %VCO2=37,33 %; %VN2=62,67%
TH2: Ca(OH)2 phản ứng hết: muối tạo thành gồm CaCO3 và Ca(HCO3)2.
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,2..........0,2...............0,2
2CO2 + Ca(OH)2 + H2O → Ca(HCO3)2
0,2.............0,1.............................0,1
⇒ nCO2 = 0,4 mol
⇒ VCO2 =8,96 lít ; VN2=3,04 lít
⇒ %VCO2=74,67%; VN2=25,33%.
5.(2đ) Hòa tan hoàn toàn 24 gam hỗn hợp A gồm MgO và Fe2O3 trong 1,2 lít dung dịch HCl 1M (lấy dư 20% so với lượng phản ứng).
a) Tính phần trăm khối lượng mỗi oxit.
b) Tính thể tích dung dịch NaOH 2M cần dung để kết tủa hết các muối chứa trong dung dịch trên.
a.
Gọi số mol của MgO và Fe2O3 lần lượt là x và y.
MgO + 2HCl → MgCl2 + H2O
x.............2x............x
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
y..............6y............2y
Ta có hệ
40x + 160y =24
2x + 6y + 0,2.(2x+6y) =1,2
⇒ x = 0,2 mol; y = 0,1 mol
⇒ %mMgO = 33,33% ; %mFe2O3 = 66,67%
b.
nHCldư = 0,2mol
HCl + NaOH → NaCl + H2O
0,2.........0,2
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
0,2..............0,4
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
0,2..........0,6
⇒ nNaOH = 1,2 mol
⇒ VNaOH = 0,6 lít
6.(2đ) Hòa tan hoàn toàn m gam hỗn hợp X gồm 2 kim loại là Fe và Al (tỉ lệ mol 2:3) bằng lượng axit H2SO4 đặc, nóng (dư 10% so với lượng phản ứng) thì thấy thoát ra V1 lít khí SO2 (đktc) là sản phẩm khử duy nhất và thu được dung dịch Y. Biết rằng dung dịch Y có thể hòa tan tối đa 9,9 gam Mg.
a) Tính giá trị m, V1.
b) Cho dung dịch Y tác dụng với V2 lít Ba(OH)2 0,1M. Tính giá trị V2 để thu được khối lượng kết tủa là cực đại. Khối lượng kết tủa cực đại bằng bao nhiêu?
a.
nMg = 0,4125 mol
Gọi số mol Al lần lượt là x; mol Fe là y.
2Al + 6H2SO4 đặc, nóng → Al2(SO4)3 + 3SO2↑ + 6H2O
x.............3x.............................0,5x..........1,5x
2Fe + 6H2SO4 đặc, nóng → Fe2(SO4)3 + 3SO2↑ + 6H2O
y.............3y.............................0,5y............1,5y
Số mol H2SO4 phản ứng là 3(x+y)
Số mol H2SO4 dư là 10%.3(x+y)=0,3(x+y)
Mg + 2H2SO4 đặc, nóng → MgSO4 + SO2↑ + 2H2O
0,15(x+y)...0,3(x+y)
3Mg + Fe2(SO4)3 → 3MgSO4 + 2Fe↓
1,5y.........0,5y
3Mg + Al2(SO4)3 → 3MgSO4 + 2Al↓
1,5x..........0,5x
Ta có hệ
1,5x + 1,5y + 0,15(x+y)=0,4125
x/y=3/2
⇒ x=0,15 mol; y=0,1 mol
⇒ m=9,65 gam; V1=8,4 lít
b.
H2SO4 + Ba(OH)2 → BaSO4↓ + H2O
0,075.......0,075............0,075
Al2(SO4)3 + 3Ba(OH)2 → 3BaSO4↓ + 2Al(OH)3↓
...0,075............0,225.............0,225.............0,15
Fe2(SO4)3 + 3Ba(OH)2 → 3BaSO4↓ + 2Fe(OH)3↓
....0,05...............0,15............ 0,15............... 0,1
nBa(OH)2 = 0,45 mol
V2 = 0,45/0,1=4,5 lít
mkettua = mBaSO4 + mFe(OH)3 + mAl(OH)3 = 0,45.233 + 0,1.107 + 0,15.78
⇒ mkettua = 127,25 gam
THE END.
Em thưa cô. Em nghĩ đề bài bài 6 có vấn đề ạ! Đề hỏi lượng NaOH cần dùng để kết tủa hết lượng muối! Nhưng cô lại giải tính cả H2SO4. Nên em mới làm sai ạ!
Ây dazzz ... Tưởng tối nay mới kết thúc Nên định chiều làm ai ngờ :((
THÔNG BÁO TỔ CHỨC CUỘC THI HÓA HỌC
(Cô đăng thay Rainbow nhé)
Loa...loa...loa...loa. Cư dân của hoc24 nghe rõ
Như trong thông báo trước thì bạn Rainbow đã nói là vào ngày 20/7 sẽ chính thức mở cuộc thi vòng 1 của môn Hóa học. Hiện tại thì đã có rất nhiều bạn đăng kí tham gia. Tuy nhiên vì một lý do khách quan mà bạn rainbow chưa thể tổ chức cuộc thi vào hôm nay được. Cuộc thi sẽ phải dời lại và sẽ được tổ chức vào ngày 23/7. Cô mong các bạn đừng quá sốt ruột nhé.Chuẩn bị tinh thần sẵn sàng nhé các học sinh thân yêu.
P/s: Các bạn còn chưa đăng kí tham gia cuộc thi Hóa học thì nhanh tay lên nhé. Vòng 1 sắp bắt đầu rồi. Có một phần quà lớn đang chờ sẵn ở cuối cuộc thi dành cho các bạn. Link đăng kí đây nhé
https://hoc24.vn/hoi-dap/question/395584.html
![]()
![]()
![]()
Hôm nay em vừa onl là vào trang của chị Rainbow mà hổng thấy gì hết, tưởng chị quên :vvv giờ thấy thông báo này của cô =))