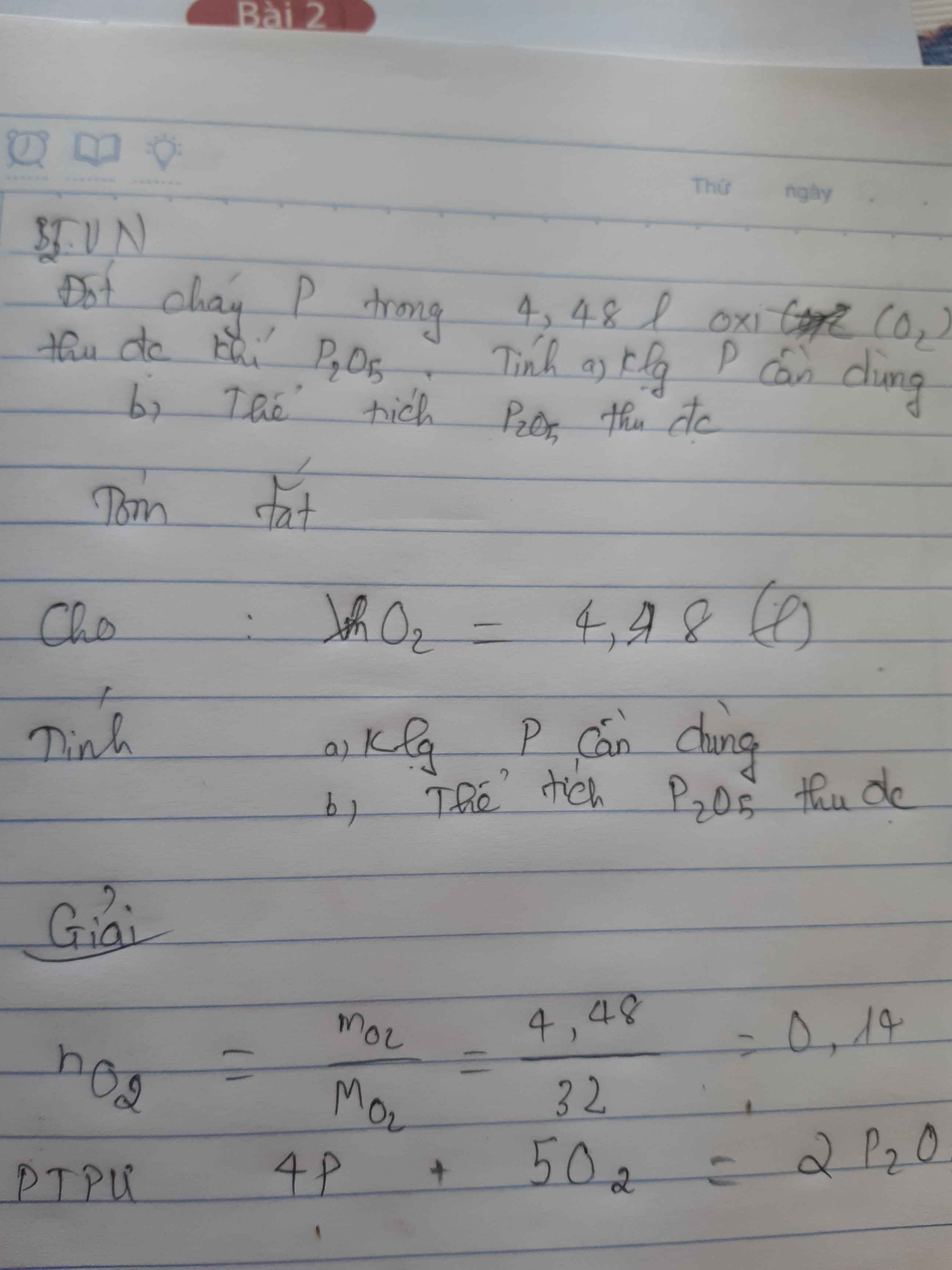s sad
sad
BT$_2$:
- Nguyên tử của nguyên tố X có 12e, 3 lớp e, 2e ở lớp ngoài cùng.
a) Xác định vị trí của X ở trong bảng tuần hoàn. X là KL, PK hay khí hiếm? Vì sao?
b) Vẽ sơ đồ nguyên tử của X.
BT$_3$: Hoàn thành bảng:
\[
\begin{array}{|c|c|c|c|c|c|c|}
\hline
& \text{Vị trí trong BTH} & \text{Cấu tạo nguyên tử} \\
\hline
& \text{Ô} & \text{Chu kì} & \text{Nhóm} & \text{Số e} & \text{Số lớp e} & \text{Số e ở lớp ngoài cùng} & \text{Điện tích hạt nhân} \\
\hline
A & & & 11 & & & & \\
\hline
B & 20 & & & & & & \\
\hline
Q & & & 16 & & & & \\
\hline
M & & & & & & & 17+ \\
\hline
\end{array}
\]
a,Lớp 2 có 12 electron, lớp ngoài cùng có 2 electron, vậy tổng cộng X có 12 + 2 = 14 electron.
Số electron bằng số proton, vậy X có 14 proton.
=> Silic (Si)
=> nguyên tố phi kim.
b, vẽ=)...
Bàiiiiiiiiiiiiiiiiii 3:
Ko vẽ đc bảng=)
A (11 electron): Là Natri (Na), thuộc ô 11, chu kì 3, nhóm IA.
B (20 electron): Là Canxi (Ca), thuộc ô 20, chu kì 4, nhóm IIA.
Q (16 electron): Là Lưu huỳnh (S), thuộc ô 16, chu kì 3, nhóm VIA
M (17+ electron): Đây là ion clo, Cl-, có 17 proton và 18 electron, thuộc ô 17, chu kì 3, nhóm VIIA.
Thông cảm=)