Cho 11,2 gam hỗn hợp gồm Cu và kim loại M tác dụng hết với HCl dư thu được 3,136 lít khí (đktc). Cũng lượng hỗn hợp này cho tác dụng hết với dung dịch H2SO4 đặc nóng dư, thu được 5,88 lít khí SO2 (đktc sản phẩm khử duy nhất). Xác định kim loại M và tính % khối lượng Cu trong hỗn hợp
Bài 16. Tính chất hóa học của kim loại
ngâm 1 bản al vào 100g dd cuso4 48% phản ứng xong lấy cân được 63,8g .hỏi khối lượng bản al ban đầu là bao nhiêu
PTHH: \(2Al+3CuSO_4\rightarrow Al_2\left(SO_4\right)_3+3Cu\)
Ta có: \(n_{CuSO_4}=\dfrac{100\cdot48\%}{160}=0,3\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,2\left(mol\right)\\n_{Cu}=0,3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow m_{bản.nhôm.ban.đầu}=63,8+m_{Al\left(p.ứ\right)}-m_{Cu}=50\left(g\right)\)
Đúng 1
Bình luận (0)
\(3.\left(a\right)Zn+2HCl\rightarrow ZnCl_2+H_2\\\left(b\right) Cu+ZnSO_4\\ \left(c\right)Fe+CuSO_4\rightarrow FeSO_4+Cu\\ \left(d\right)Zn+Pb\left(NO_3\right)_2\rightarrow Zn\left(NO_3\right)_2+Pb\\\left(e\right)Cu+HCl\\ \left(g\right)Ag+H_2SO_{4\left(loãng\right)}\\ \left(h\right)Ag+CuSO_4\\ \left(i\right)Ba+H_2O\rightarrow Ba\left(OH\right)_2\\ \left(k\right)2Mg+O_2-^{t^o}\rightarrow2MgO\\ \left(l\right)Cu+H_2O\\ \left(m\right)4Ag+O_2-^{t^o}\rightarrow2Ag_2O\\ \left(n\right)Fe+\dfrac{3}{2}Cl_2-^{t^o}\rightarrow FeCl_3\)
Đúng 1
Bình luận (0)
4.a) Sắt cháy sáng tạo thành khói màu nâu đỏ
\(Fe+\dfrac{3}{2}Cl_2-^{t^o}\rightarrow FeCl_3\)
b) Sắt (Fe) màu xám ánh kim tan dần trong dung dịch, xuất hiện lớp đồng (Cu) màu đỏ sáng.
\(Fe+CuCl_2\rightarrow FeCl_2+Cu\)
c) Không có hiện tượng do không phản ứng
d) Hiện tượng: có khí không màu thoát ra, thu được kết tủa xanh đậm. Dung dịch sau phản ứng làm phenolphtalein hóa hồng (do có NaOH)
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\\2 NaOH+CuSO_4\rightarrow Na_2SO_4+Cu\left(OH\right)_2\)
Đúng 1
Bình luận (0)
Cho 25,7 gam hỗn hợp(P) gồm Al,Fe,Cu phản ứng vừa đủ với 500ml dung dịch axit clohydric x mol/lít thu được 14,56 lít khí X(đktc) dung dịch Y và 6,4 gam chất rắn Za.Tính phần trăm về khối lượng kim loại trong (P)b.Tính giá trị của X c.Cho hoàn toàn Z vào 100ml dung dịch bạc nitrat 1,5M. Giả sử phản ứng xảy ra hoàn toàn. Tính khối lượng chất rắn sau phản ứng
Đọc tiếp
Cho 25,7 gam hỗn hợp(P) gồm Al,Fe,Cu phản ứng vừa đủ với 500ml dung dịch axit clohydric x mol/lít thu được 14,56 lít khí X(đktc) dung dịch Y và 6,4 gam chất rắn Z
a.Tính phần trăm về khối lượng kim loại trong (P)
b.Tính giá trị của X
c.Cho hoàn toàn Z vào 100ml dung dịch bạc nitrat 1,5M. Giả sử phản ứng xảy ra hoàn toàn. Tính khối lượng chất rắn sau phản ứng
a) Chất rắn Z là Cu
\(\%m_{Cu}=\dfrac{6,4}{25,7}.100=24,9\%\)
Gọi x, y là số mol Al, Fe
2Al + 6HCl → 2AlCl3 + 3H2
Fe + 2HCl → FeCl2 + H2
\(\left\{{}\begin{matrix}\dfrac{3}{2}x+y=0,65\\27x+56y=19,3\end{matrix}\right.\)
=> x=0,3; y=0,2
\(\%m_{Al}=\dfrac{0,3.27}{25,7}.100=31,52\%\)
%mFe=43,58%
b)Khí X là H2
\(m_{H_2}=0,65.2=1,3\left(g\right)\)
c) \(Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\)
\(n_{Cu}=0,1\left(mol\right);n_{AgNO_3}=0,15\left(mol\right)\)
Lập tỉ lệ : \(\dfrac{0,1}{1}>\dfrac{0,15}{2}\) => Sau phản ứng Cu dư
\(m_{cr}=m_{Cu\left(dư\right)}+m_{Ag}=\left(0,1-0,075\right).64+0,15.108=17,8\left(g\right)\)
Đúng 3
Bình luận (0)
a) mZ= mCu= 6,4(g) (Vì Cu không td dung dịch HCl)
=> m(Al, Fe)= 25,7 - 6,4= 19,3(g)
Đặt nAl=a(mol); nFe=b(mol) (a,b>0)
nH2= 14,56/22,4=0,65(mol)
PTHH: 2Al + 6 HCl -> 2 AlCl3 + 3 H2
a_________3a_____a_______1,5a(mol)
Fe + 2 HCl -> FeCl2 + H2
b____2b____b___b(mol)
Ta có hệ pt:
\(\left\{{}\begin{matrix}27a+56b=19,3\\3a+2b=0,65\end{matrix}\right.\)
Có vẻ số liệu lẻ, em có thể xem lại đề được không?
Đúng 1
Bình luận (0)
Bài 1: Hòa tan hết 7,74 g hỗn hợp 2 kim loại magie và nhôm bằng 500ml dung dịch chứa hai axit HCl 1M và H2SO4 0,28M thu được dung dịch A và 8,736 lít khí H2 (đktc). Viết PTHH và tính khối lượng muối khan thu được khi cô cạn dung dịch A.
\(n_{HCl}=0.5\cdot1=0.5\left(mol\right)\)
\(n_{H_2SO_4}=0.5\cdot0.28=0.14\left(mol\right)\)
\(\Rightarrow n_{H^+}=0.5+0.14\cdot2=0.75\left(mol\right)\)
\(n_{H_2}=\dfrac{8.736}{22.4}=0.39\left(mol\right)\)
\(Mg+2H^+\rightarrow Mg^{2+}+H_2\)
\(2Al+6H^+\rightarrow2Al^{3+}+3H_2\)
\(n_{H_2}>2n_{H^+}\)
=> Đề sai
Đúng 1
Bình luận (0)
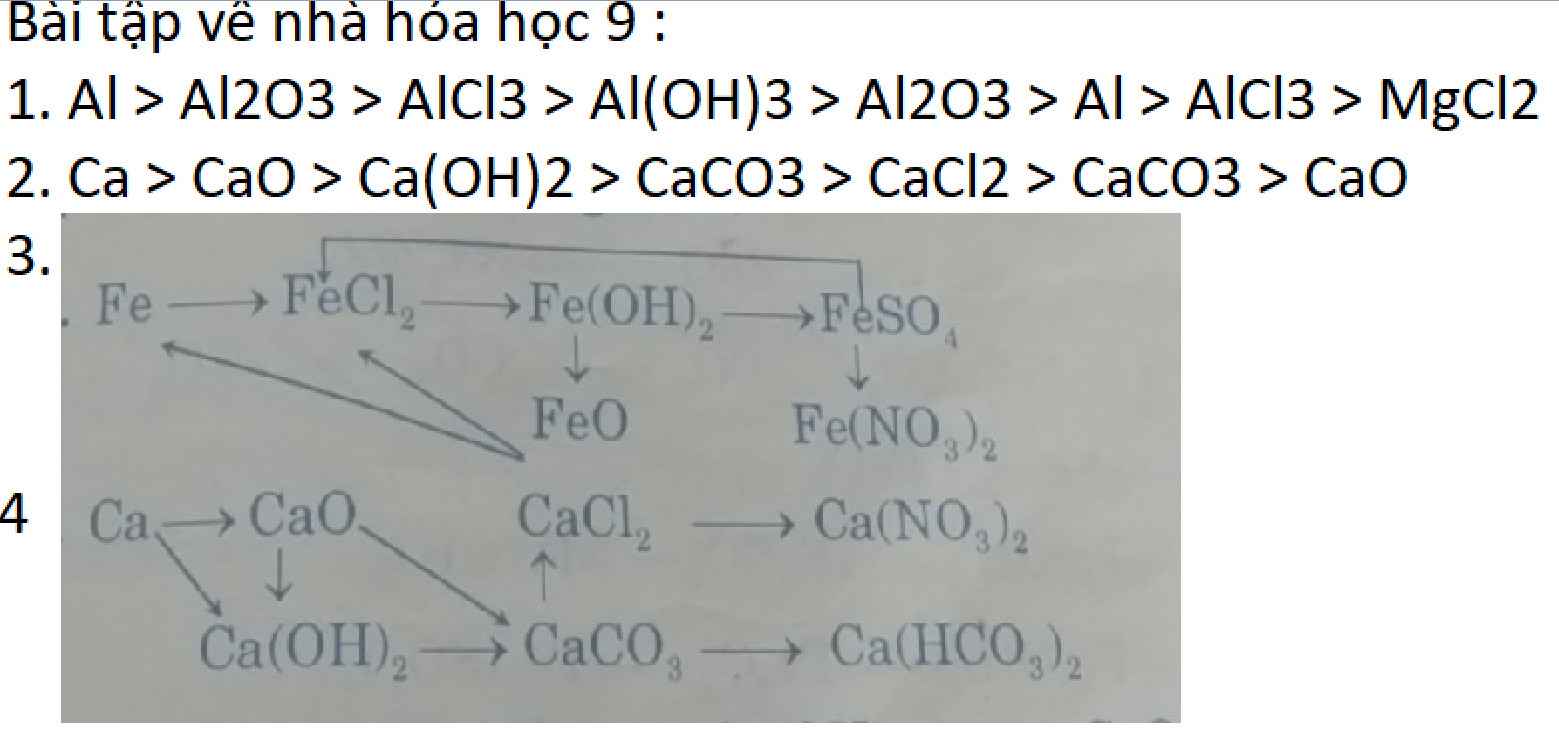
Chuỗi 1:
(1) 4 Al + 3 O2 -to-> 2 Al2O3
(2) Al2O3 + 6 HCl -> 2 AlCl3 + 3 H2O
(3) AlCl3 + 3 NaOH -> 3 NaCl + Al(OH)3
(4) 2 Al(OH)3 -to-> Al2O3 + 3 H2O
(5) 2 Al2O3 -đpnc-> 4 Al + 3 O2
(6) 2Al + 6 HCl -> 2 AlCl3 + 3 H2
(7) 2 AlCl3 + 3 Mg -> 3 MgCl2 +2 Al
Đúng 4
Bình luận (0)
Chuỗi 2:
(1) Ca + 1/2 O2 -to-> CaO
(2) CaO + H2O -> Ca(OH)2
(3) Ca(OH)2 + CO2 -> CaCO3 + H2O
(4) CaCO3 + BaCl2 -> BaCO3+ CaCl2
(5) CaCl2 + Na2CO3 -> 2 NaCl + CaCO3
(6) CaCO3 -to-> CaO + CO2
Đúng 4
Bình luận (0)
Chuỗi 4:
(1) Ca + 1/2 O2 -to-> CaO
(2) Ca + 2 H2O -> Ca(OH)2 + H2
(3) CaO + H2O -> Ca(OH)2
(4) CaO + CO2 -> CaCO3
(5) Ca(OH)2 + CO2 -to-> CaCO3 + H2O
(6) CaCO3 + 2 HCl -> CaCl2 + CO2 + H2O
(7) CaCl2 + 2 AgNO3 -> Ca(NO3)2 + 2 AgCl
(8) CaCO3 + CO2 (dư) + H2O -> Ca(HCO3)2
Đúng 1
Bình luận (0)
Ngâm 1 lá đồng vào 300g dung dịch AgNO3 5% .a) tính kg đồng và khối lượng của bạc bị đẩy ra.b) tính C% của dung dịch sau phản ứng
\(n_{AgNO_3}=\dfrac{300.5\%}{170}=\dfrac{3}{34}\left(mol\right)\)
\(Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\)
Ta có : \(n_{Cu}=\dfrac{1}{2}n_{AgNO_3}=\dfrac{3}{68}\left(mol\right)\)
=> \(m_{Cu}=\dfrac{3}{68}.64=2,82\left(g\right)\)
\(n_{Ag}=n_{AgNO_3}=\dfrac{3}{34}\left(mol\right)\)
=>\(m_{Ag}=\dfrac{3}{34}.108=9,53\left(g\right)\)
\(m_{ddsaupu}=2,82+300-9,53=293,29\left(g\right)\)
Ta có : \(n_{Cu\left(NO_3\right)_2}=\dfrac{1}{2}n_{AgNO_3}=\dfrac{3}{68}\left(mol\right)\)
\(\Rightarrow C\%_{Cu\left(NO_3\right)_2}=\dfrac{\dfrac{3}{68}.188}{293,29}.100=2,83\%\)
Đúng 1
Bình luận (0)
Cho ví dụ về trường hợp kim loại + muối --> 2 muối mới
Ví dụ :
\(Cu + Fe_2(SO_4)_3 \to CuSO_4 + 2FeSO_4\)
2 muối mới là \(CuSO_4,FeSO_4\)
Đúng 2
Bình luận (1)
Hãy cho biết hiện tượng xảy ra khi nhúng một viên kẽm vào:
a, Nhúng viên kẽm vào dd HCl
b, Rắc bột nhôm trên ngọn lửa đèn cồn
c, Cho mẩu Natri vào nước đựng nước cất có pha thêm dd phenolphtalein
a, Chất rắn màu xám sẫm Kẽm (Zn) tan dần và xuất hiện bọt khí do khí Hidro (H2) tạo thành.
b, Cháy sáng trong không khí với ngọn lửa sáng chói, tỏa nhiều nhiệt, tạo ra Al2O3 .
c, Mẫu Na chuyển động nhanh trên mặt nước , tan dần cho đến hết, có khí H2 bay ra, phản ứng toả nhiều nhiệt đồng thời dung dịch chuyển sang màu hồng .
Đúng 1
Bình luận (0)
a) Hiện tượng :
- Viên kẽm tan dần trong dd axit
- Xuất hiện bọt khí không màu thoát ra
b) Hiện tượng : Có chất rắn màu trắng xuất hiện
c) Hiện tượng :
+ Mẩu Natri tan dần
+ Xuất hiện bọt khí không màu thoát ra
+ Dung dịch trong suốt chuyển dần sang màu đỏ
Đúng 0
Bình luận (0)