Trộn 200 mL dung dịch HNO3 0,002M vào 200 mL dung dịch HC1 0,001M. Thì thu được dung dịch X
mng ơi cho e hỏi lúc tính pH, pOH mà nó ra số lẻ thì có làm tròn lên kh ạ, kiểu 1,37653333 thì có làm tròn lên 1,38 hong hay chỉ là 0,37 th v ạ
Giỉa giupa mình với ạ mk cảm ơn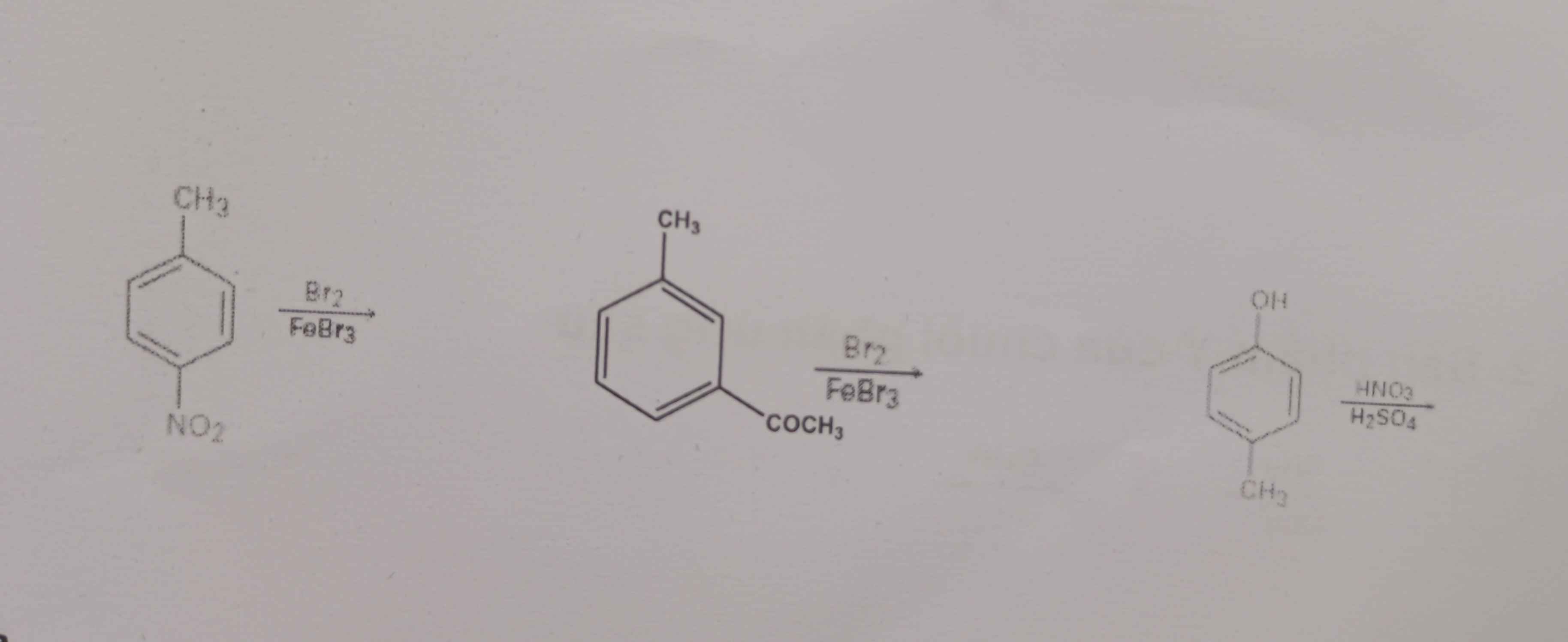
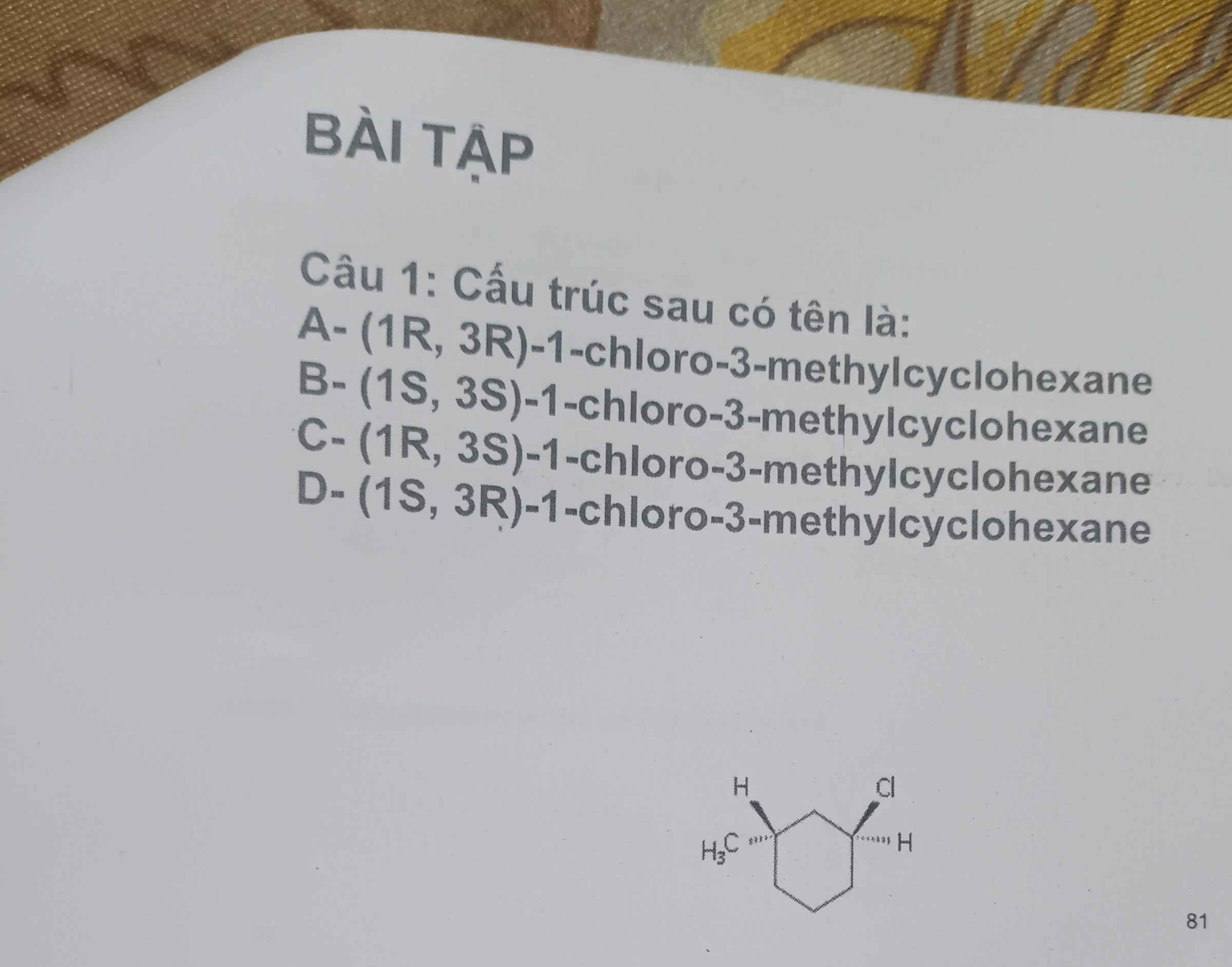 giúp mình giải với ạ
giúp mình giải với ạ
Giúp mình giải bài này với ạ
1.Viết các đồng phân và gọi tên thấy thế của Ankin có CTPT là C5H8
Tên gọi theo danh pháp IUPAC nhé
Pent-1-in: \(CH_3-CH_2-CH_2-C\equiv CH\)
Pent-2-in:\(CH_3-CH_2-C\equiv CH-CH_3\)
2-Metylbut-1-in: \(\left(CH_3\right)_2CH-CH\equiv CH\)
3-Metylbut-1-in; \(CH_3-CH_2-C\equiv C-CH_3\)
Đúng 2
Bình luận (0)
Cho phản ứng tổng hợp amonia
N2 + 3H2 <=>2NH3
a. Tính hằng số cân bằng của phản ứng ở trạng thái cân bằng, nồng độ của NH3 là 0,3 mol/l của N2 0,05mol/l H2 là 0,1 mol/l
b. Tính hiệu suất của phản ứng tổng hợp amonia nếu nồng độ bạn đầu của N2 là 1 mol/l H2 là 0,3 mol/l .
a) Hằng số cân bằng của phản ứng ở trạng thái cân bằng :
\(K_C=\dfrac{\left[NH_3\right]^2}{\left[N_2\right]\left[H_2\right]^3}=\dfrac{0,3^2}{0,05.0,1^3}=1800\)
b) \(\dfrac{n_{H_2}}{n_{N_2}}=\dfrac{0,3}{1}=0,3< 3\)
\(\Rightarrow N_2\) dư (so với lượng cần thiết)
\(\Rightarrow\left\{{}\begin{matrix}n_{phản.ứng}\left(N_2\right)=0,05\\n_{ban.đầu}\left(N_2\right)=1\end{matrix}\right.\)
Hiệu suất của phản ứng tổng hợp amoniac :
\(H\%=\dfrac{n_{phản.ứng}\left(N_2\right)}{n_{ban.đầu}\left(N_2\right)}.100\%=\dfrac{0,05}{1}.100\%=5\%\)
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn một hợp chất hữu cơ X thu được 6,6 gam CO2 , 3,15 gam nước và 0,61975 L khí N2 (đkc) . Biết dX/H2 = 44,5 và X chứa 1 nguyên tử nitrogen. CTPT của X là
\(n_{CO_2}=\dfrac{6,6}{44}=0,15\left(mol\right)\\ n_{H_2O}=\dfrac{3,15}{18}=0,175\left(mol\right)\\ n_{N_2}=\dfrac{0,61975}{2479}=0,025\left(mol\right)\)
=> \(\left\{{}\begin{matrix}n_{C\left(X\right)}=n_{CO_2}=0,15\left(mol\right)\left(BT.C\right)\\n_{H\left(X\right)}=2n_{H_2O}=2.0,175=0,35\left(mol\right)\left(BT.H\right)\\n_{N\left(X\right)}=2n_{N_2}=0,025.2=0,05\left(mol\right)\left(BT.N\right)\end{matrix}\right.\)
Gọi CTHH của X là \(C_xH_yN_z\)
Có: \(x:y:z=0,15:0,35:0,05=3:7:1\)
=> CTĐG: \(C_3H_7N=57\left(\dfrac{g}{mol}\right)\)
=> X có chứa Oxi => CTPT: \(C_3H_7O_aN\)
\(M_X=44,5.2=89\) g/mol
=> \(a=\dfrac{89-57}{16}=2\)
=> CTPT của X: \(C_3H_7O_2N\)
Đúng 1
Bình luận (0)
Ở 800oC, hằng số cân bằng của phản ứng:
CO(g) + H2O(g) ⇌ CO2(g) + H2(g) : Hằng số cân bằng KC =1.
Nồng độ ban đầu của CO là 0,2 M và H2O là 0,8 M. Nồng độ H2 tại thời điểm cân bằng là?
CO + H2O \(⇌\) CO2 + H2
Ban đầu 0,2 0,8 0 0
Phản ứng a a a a
Cân bằng (0,2-a) (0,8-a) a a
Ta có:\(K_c=1\)
\(\Leftrightarrow\dfrac{a^2}{\left(0,2-a\right)\left(0,8-a\right)}=1\)
\(\Rightarrow a=0,16\)
Vậy \(\left[H_2\right]=a=0,16M\)
Đúng 2
Bình luận (0)
Trộn 600mL dung dịch HNO3 0,1M với 400mL dung dịch Ba(OH)2 0,05M thu được dung dịch X. Coi như thể tích dung dịch thay đổi không đáng kể, tổng nồng độ mol (M) của các cation trong X là? (Giải chi tiết)
\(n_{HNO_3}=0,6.0,1=0,06\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,4.0,5=0,02\left(mol\right)\)
\(Ba\left(OH\right)_2+2HNO_3\rightarrow Ba\left(NO_3\right)_2+2H_2O\)
\(\Rightarrow Ba\left(OH\right)_2\) hết,\(HNO_3\) dư
\(V_{dd}=0,6+0,4=1l\)
\(n_{Ba\left(NO_3\right)_2}=0,02\left(mol\right)\Rightarrow C_{Ba\left(NO_3\right)_2}=\dfrac{0,02}{1}=0,02M\)
\(n_{HNO_3dư}=0,06-0,02.2=0,02\left(mol\right)\Rightarrow C_{HNO_3}=\dfrac{0,02}{1}=0,02M\)
Tổng nồng độ cation:
\(\left[Ba^{2+}\right]+\left[H^+\right]=0,2+0,2=0,4M\)
Đúng 1
Bình luận (0)













