Nhỏ từ từ dung dịch Ba(OH)2 vào ống nghiệm chứa dung dịch HCl (a mol) và Al2(SO4)3 (b mol). Đồ thị biểu diễn sự phụ thuộc khối lượng kết tủa theo thể tích dung dịch Ba(OH)2 như sau. Tính giá trị của a:b? ( trình bày chi tiết giúp em theo pthh với!)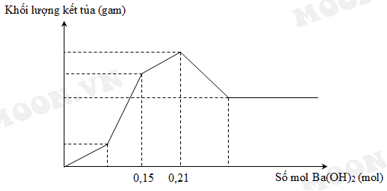
Bài 18. Nhôm
Cho 10 gam hỗn hợp gồm Al và Cu vào dung dịch HCl dư thấy thoát ra 7,437 lít khí hydrogen H2 (ở đkc). Khối lượng của Copper (Cu) trong hỗn hợp ban đầu là:(Al = 27; Cu = 64) *
\(n_{H_2}=\dfrac{7,437}{24,79}=0,3(mol)\\ PTHH:2Al+6HCl\to 2AlCl_3+3H_2\\ \Rightarrow n_{Al}=\dfrac{2}{3}n_{H_2}=0,2(mol)\\ \Rightarrow m_{Al}=0,2.27=5,4(g)\\ \Rightarrow m_{Cu}=m_{hh}-m_{Al}=10-5,4=4,6(g)\)
Đúng 1
Bình luận (0)
Cho m gam hỗn hợp X gồm Al, Fe (có tỉ lệ khối lượng theo thứ tự 3:7) vào 110 gam dung dịch H2SO4 98% (đặc, nóng). Sau khi kết thúc phản ứng thu được 0,75m gam chất rắn (không chứa S), dung dịch Y và 11,2 lít (đktc) hỗn hợp khí SO2, H2S. a. Tính m b. Cho V lít dung dịch NaOH 2M vào dung dịch Y thu được 7,8 gam kết tủa. Tính V
\(m_{phản.ứng}=0,25m\left(g\right)\)
\(m\left(g\right)X\left\{{}\begin{matrix}m_{Al}:0,3m\left(g\right)\\m_{Fe}:0,7m\left(g\right)\end{matrix}\right.\)
Nhận thấy: 0,25m < 0,3m => Al dư, Fe chưa phản ứng
Gọi \(\left\{{}\begin{matrix}n_{SO_2}=a\left(mol\right)\\n_{H_2S}=b\left(mol\right)\end{matrix}\right.\) => \(a+b=\dfrac{11,2}{22,4}=0,5\) (*)
\(n_{H_2SO_4}=\dfrac{110.98\%}{98}=1,1\left(mol\right)\)
PTHH:
\(2Al+6H_2SO_{4\left(đ,n\right)}\rightarrow Al_2\left(SO_4\right)_3+3SO_2+6H_2O\)
\(\dfrac{2}{3}a\)<---2a<---------------\(\dfrac{1}{3}a\)<-----------a
\(8Al+15H_2SO_{4\left(đ,n\right)}\rightarrow4Al_2\left(SO_4\right)_3+3H_2S+12H_2O\)
\(\dfrac{8}{3}b\)<---5a<---------------\(\dfrac{4}{3}b\)<-------------b
=> 2a + 5b = 1,1 (**)
Từ (*), (**) => \(\left\{{}\begin{matrix}a=\dfrac{7}{15}\\b=\dfrac{1}{30}\end{matrix}\right.\)
=> \(n_{Al\left(pư\right)}=\dfrac{2}{3}.\dfrac{7}{15}+\dfrac{1}{30}.\dfrac{8}{3}=0,4\left(mol\right)\)
=> m = \(\dfrac{0,4.27}{0,25}=43,2\left(g\right)\)
b) \(\left\{{}\begin{matrix}n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,2\left(mol\right)\\n_{Al\left(OH\right)_3}=\dfrac{7,8}{78}=0,1\left(mol\right)\end{matrix}\right.\)
TH1: Kết tủa không bị hoà tan
\(Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3\downarrow+3Na_2SO_4\)
0,3<---------0,1
=> \(V=\dfrac{0,3}{2}=0,15\left(l\right)\)
TH2: Kết tủa bị hoà tan 1 phần
\(Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3\downarrow+3Na_2SO_4\)
0,1----------->0,6----------->0,2
\(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\)
0,1<-------0,1
=> \(V=\dfrac{0,1+0,6}{2}=0,35\left(l\right)\)
Đúng 1
Bình luận (0)
Dẫn khí H2 dư đi qua hỗn hợp A gồm CuO, Fe2O3, K2O, Al2O3, MgO nung nóng, sau phản ứng thu được hỗn hợp rắn B. Cho hỗn hợp B vào dung dịch Ba(OH)2, sau phản ứng hoàn toàn thu được dung dịch C (chứa 2 chất tan) và chất rắn D. Sục khí CO2 dư vào dung dịch C thì thu được kết tủa G. Cho D vào dung dịch H2SO4 đặc, nóng thì được dung dịch E, khí F mùi hắc và chất rắn chứa 1 kim loại. Xác định thành phần A, B, C, D, F, G và viết phương trình xảy ra.
Đọc tiếp
Dẫn khí H2 dư đi qua hỗn hợp A gồm CuO, Fe2O3, K2O, Al2O3, MgO nung nóng, sau phản ứng thu được hỗn hợp rắn B. Cho hỗn hợp B vào dung dịch Ba(OH)2, sau phản ứng hoàn toàn thu được dung dịch C (chứa 2 chất tan) và chất rắn D. Sục khí CO2 dư vào dung dịch C thì thu được kết tủa G. Cho D vào dung dịch H2SO4 đặc, nóng thì được dung dịch E, khí F mùi hắc và chất rắn chứa 1 kim loại. Xác định thành phần A, B, C, D, F, G và viết phương trình xảy ra.
Cho 6,75g kim loại của nhôm tác dụng với 196g dd axit sufuric 15% . Tính thể tích khí hiđro thoát ra ở đktc
Vì sao Mg không thể làm sạch AlCl3 bị lẫn tạp chất CuCl2 ?
vì khi đó AlCl3 bị lẫn tạp chất MgCl2.
Cách đúng cho bột Al vào dd, lọc bỏ phần rắn không tan thu được dd AlCl3
2Al + 3CuCl2 → 2AlCl3 + 3Cu↓
Đúng 0
Bình luận (0)
Hòa tan hết m gam hỗn hợp X gồm Na, Na2O, K, K2O, Ba, BaO (trong X, oxi chiếm 8,75% về khối lượng) vào nước, thu được 400 ml dung dịch Y và 1,568 lít H2 (đktc). Trộn 200 ml dung dịch Y với 200 ml dung dịch Z gồm HCl 0,2M và H2SO4 0,15M thu được 400 ml dung dịch T. Để trung hòa vừa hết dung dịch T cần phải thêm 40ml dung dịch HNO3 1M. Các phản ứng xảy ra hoàn toàn. a) Tính m. b) Nếu cô cạn 400ml dung dịch Y thì thu được bao nhiêu gam chất rắn khan?
Đọc tiếp
Hòa tan hết m gam hỗn hợp X gồm Na, Na2O, K, K2O, Ba, BaO (trong X, oxi chiếm 8,75% về khối lượng) vào nước, thu được 400 ml dung dịch Y và 1,568 lít H2 (đktc). Trộn 200 ml dung dịch Y với 200 ml dung dịch Z gồm HCl 0,2M và H2SO4 0,15M thu được 400 ml dung dịch T. Để trung hòa vừa hết dung dịch T cần phải thêm 40ml dung dịch HNO3 1M. Các phản ứng xảy ra hoàn toàn. a) Tính m. b) Nếu cô cạn 400ml dung dịch Y thì thu được bao nhiêu gam chất rắn khan?
Nhỏ từ từ dung dịch Ba(OH)2 vào dung dịch chứa đồng thời HCl và Al2(SO4)3. Khối lượng kết tủa phụ thuộc vào số mol Ba(OH)2 được biểu diễn như hình sau. Tìm tổng (x+y). (Làm theo phương trình hóa học giúp mình nhé!)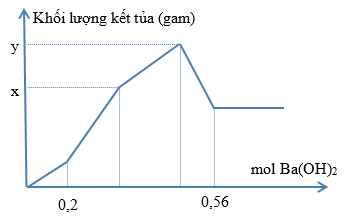
Đoạn OA :
\(Ba\left(OH\right)_2+2HCl\text{→}BaCl_2+2H_2O\)
0,2 0,2 (mol)
\(3BaCl_2+Al_2\left(SO_4\right)_3\text{→}3BaSO_4+2AlCl_3\)
0,2 0,6 \(\dfrac{0,4}{3}\) (mol)
Đoạn AB :
\(3Ba\left(OH\right)_2+Al_2\left(SO_4\right)_3\text{→}3BaSO_4+2Al\left(OH\right)_3\)
3a 3a 2a (mol)
Đoạn BC :
\(2AlCl_3+3Ba\left(OH\right)_2\text{→}2Al\left(OH\right)_3+3BaCl_2\)
\(\dfrac{0,4}{3}\) 0,2 \(\dfrac{0,4}{3}\) (mol)
Đoạn CD :
\(2Al\left(OH\right)_3+Ba\left(OH\right)_2\text{→}Ba\left(AlO_2\right)_2+4H_2O\)
(\(\dfrac{0,4}{3}\)+2a) (\(\dfrac{0,2}{3}\) + a) (mol)
$\Rightarrow n_{Ba(OH)_2} = 0,2 + 3a + 0,2 + \dfrac{0,2}{3} + a = 0,56 \Rightarrow a = \dfrac{7}{300}$
Suy ra:
$x = 0,6.233 + 3a.233 + 2a.78 = 139,8 + 855a = 159,75(gam)$
$y = x + \dfrac{0,4}{3}.78 = 170,15(gam)$
Đúng 1
Bình luận (0)
Cho 2 dung dịch: dung dịch A (Al2(SO4)3) và dung dịch B (NaOH) đều chưa biết nồng độ. - TN1: Trộn 100ml dung dịch A với 120ml dung dịch B, được kết tủa, sau khi nung được chất rắn có khối lượng 2,04 gam. - TN2: Trộn 100ml dung dịch A với 200ml dung dịch B, lấy kết tủa đem nung ta được 2,04 gam chất rắn. a) Chứng tỏ rằng trong TN1, Al(OH)3 chưa tan trở lại, xác định nồng độ mol của 2 dung dịch A và B. b) Phải thêm vào 100ml dung dịch A bao nhiêu ml dung dịch B để cho chất rắn thu được sau khi nun...
Đọc tiếp
Cho 2 dung dịch: dung dịch A (Al2(SO4)3) và dung dịch B (NaOH) đều chưa biết nồng độ. - TN1: Trộn 100ml dung dịch A với 120ml dung dịch B, được kết tủa, sau khi nung được chất rắn có khối lượng 2,04 gam. - TN2: Trộn 100ml dung dịch A với 200ml dung dịch B, lấy kết tủa đem nung ta được 2,04 gam chất rắn. a) Chứng tỏ rằng trong TN1, Al(OH)3 chưa tan trở lại, xác định nồng độ mol của 2 dung dịch A và B. b) Phải thêm vào 100ml dung dịch A bao nhiêu ml dung dịch B để cho chất rắn thu được sau khi nung kết tủa có khối lượng 1,224 gam.
a) Dù dùng $V_{dd\ B\ ở\ TN2} > V_{dd\ B\ ở\ TN1}$ mà lượng kết tủa thu được vẫn bằng nhau. Suy ra : ở TN1, kết tủa chưa đạt tối đa, tức là $Al(OH)3$ chưa bị hòa tan trở lại.
Gọi $C_{M_A} = a(M) ; C_{M_B} = b(M)$
$n_{Al_2O_3} = 0,02 \Rightarrow n_{Al(OH)_3} = 0,04(mol)$
TH1 :
$Al_2(SO_4)_3 + 6NaOH \to 2Al(OH)_3 + 3Na_2SO_4$
$n_{Al_2(SO_4)_3} = \dfrac{1}{2}n_{Al(OH)_3} = 0,06(mol) \Rightarrow ba= \dfrac{0,06}{0,1} = 0,6M$
TN2 :
\(Al_2\left(SO_4\right)_3+6NaOH\text{→}2Al\left(OH\right)_3+3Na_2SO_4\)
0,06 0,36 0,12 (mol)
\(Al\left(OH\right)_3+NaOH\text{→}NaAlO_2+2H_2O\)
0,08 0,08 (mol)
$\Rightarrow n_{NaOH} = 0,36 + 0,08 = 0,44(mol) \Rightarrow b =\dfrac{0,44}{0,2} = 2,2M$
b)
$n_{Al_2O_3} = 0,012(mol) \Rightarrow n_{Al(OH)_3} = 0,024(mol)$
\(Al_2\left(SO_4\right)_3+6NaOH\text{→}2Al\left(OH\right)_3+3Na_2SO_4\)
0,06 0,36 0,12 (mol)
\(Al\left(OH\right)_3+NaOH\text{→}NaAlO_2+2H_2O\)
0,096 0,096 (mol)
$n_{NaOH} = 0,36 + 0,096 = 0,456 \Rightarrow V_{dd\ B} =\dfrac{0,456}{2,2} = 0,207(lít)$
Đúng 1
Bình luận (1)
Cuối mình hỏi câu 3 phần 2kloai
Em tách nhỏ phần hỏi ra nha!
Đúng 0
Bình luận (0)

















