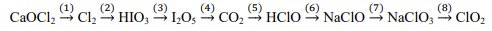1/ Để nhận biết ion sulfite, người ta cho vào một ống nghiệm 1-2 giọt dung dịch iodine, 3-4 giọt dung dịch A có chứa ion sulfite (1). Sau đó cho tiếp vào đó 2-3 giọt dung dịch HCl và vài giọt dung dịch BaCl2 thấy xuất hiện kết tủa B (2).
a) Nêu hiện tượng xảy ra trong các giai đoạn (1) và (2) của thí nghiệm và viết phương trình hóa học để minh họa.
b) Cho biết tại sao thí nghiệm nhận biết ion sulfite nêu trên thường được tiến hành trong môi trường acid hoặc môi trường trung hòa, không được tiến hành trong môi trường base?
2/ Trong công nghiệp, bromine được điều chế từ nước biển theo quy trình như sau: Cho một lượng dung dịch H2SO4 vào một lượng nước biển, tiếp theo sục khí chlorine vào dung dịch mới thu được (1), sau đó dùng không khí lôi cuốn hơi bromine vào dung dịch Na2CO3 tới bão hòa bromine (2). Cuối cùng cho H2SO4 vào dung dịch bão hòa bromine (3), thu hơi bromine rồi hóa lỏng. Hãy viết các phương trình hóa học chính xảy ra trong các quá trình (1), (2), (3)