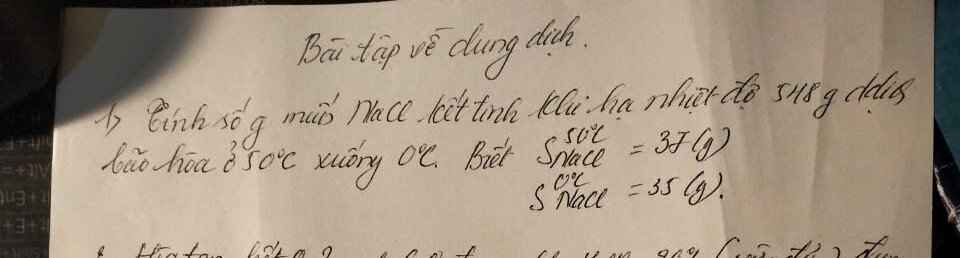Thành phần chính của khí thiên nhiên là khí methane
Đúng 2
Bình luận (0)
thanh phan chinh cua khi thien nhien thuong la methane(CH4).
Đúng 0
Bình luận (0)
Bài 8. Có 2 thanh kim loại R(Hóa trị II) có cùng khối lượng.Thả thanh thứ nhất vào dung dịch CuSO4 và à thanh thứ 2 vào dung dịch AgNO3. Sau khi kêu thúc phản ứng, lấy 2 thanh kim loại đó ra khỏi dung dịch thấy khối lượng thanh thứ nhất nhẹ hơn so với ban đầu, cũn thanh thứ 2 nặng hơn so với ban đầu. Biết tất cả kim loại sinh ra đều bám vào thanh R, phần khối lượng tăng thêm gấp 75,5 lần khối lượng giảm đi và sử mol 2 kim loại bám vào thanh R trong 2 thí nghiệm trên đều bằng nhau. Xác định tên k...
Đọc tiếp
Bài 8. Có 2 thanh kim loại R(Hóa trị II) có cùng khối lượng.
Thả thanh thứ nhất vào dung dịch CuSO4 và à thanh thứ 2 vào dung dịch AgNO3. Sau khi kêu thúc phản ứng, lấy 2 thanh kim loại đó ra khỏi dung dịch thấy khối lượng thanh thứ nhất nhẹ hơn so với ban đầu, cũn thanh thứ 2 nặng hơn so với ban đầu. Biết tất cả kim loại sinh ra đều bám vào thanh R, phần khối lượng tăng thêm gấp 75,5 lần khối lượng giảm đi và sử mol 2 kim loại bám vào thanh R trong 2 thí nghiệm trên đều bằng nhau. Xác định tên kim loại R?
Hào tan hoàn tan 1,37 g hỗn hợp bao gồm Al và Fe có trong 100ml dung dịch A gồm có H2S04 0,45M và HCl 0,2M (vừa đủ ) . Cho dung dịch thu được tác dụng với 100ml KOH 1,4M , lọc kết tủa đem nung thu được m gam chắt rắn . Tính m và % khối lượng kim loại trong hỗn hợp ban đầu
Hòa tan hoàn toàn 1,37 g Al và Fe có trong 100.l dung dịch A gồm H2S04 0,45M và HCl 0,2 M (vừa đủ) .cho dung dịch thu được tác dụng với 100ml KOH 1,4M , lọc kết tủa đem nung thu được m gam chắt rắn .Tính m và C% khối lượng kim loại trong hỗn hợp ban đầu
1)Cho a (g) dung dịch H2SO4 C% tác dụng với Na dư thì sinh ra 0,05a (g) H2.Tính C%=? 2)Hòa tan vừa đủ b (g) oxide của kim loại M (hóa trị không đổi là ll) vào acid H2SO4 (phần 1) thu được muối có C%= 18,21%. Xác định M
1)
PT: \(2Na+H_2SO_4\rightarrow Na_2SO_4+H_2\)
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
Ta có: \(n_{H_2SO_4}=\dfrac{a.C\%}{98}\left(mol\right)\)
mH2O (trong acid) = a - a.C% \(\Rightarrow n_{H_2O}=\dfrac{a-a.C\%}{18}\left(mol\right)\)
\(n_{H_2}=\dfrac{0,05a}{2}=0,025\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}+\dfrac{1}{2}n_{H_2O}=n_{H_2}\)
\(\Rightarrow\dfrac{a.C\%}{98}+\dfrac{1}{2}.\dfrac{a-a.C\%}{18}=0,025a\Rightarrow C=15,8\%\)
2)
PT: \(MO+H_2SO_4\rightarrow MSO_4+H_2O\)
Ta có: \(n_{MO}=\dfrac{b}{M_M+16}\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{MSO_4}=n_{MO}=\dfrac{b}{M_M+16}\left(mol\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{\dfrac{b}{M_M+16}.98}{15,8\%}=\dfrac{620,25b}{M_M+16}\left(g\right)\)
⇒ m dd sau pư = b + 620,25b/(MM + 16) (g)
\(\Rightarrow C\%_{MSO_4}=\dfrac{\dfrac{b}{M_M+16}.\left(M_M+96\right)}{b+\dfrac{620,25b}{M_M+16}}.100\%=18,21\%\)
⇒ MM = 24 (g/mol)
→ M là Mg.
Đúng 1
Bình luận (0)
Bài 6:
PT: \(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
Gọi: CM của dd A và dd B lần lượt là a, b.
- TN1: nH2SO4 = 3a (mol), nNaOH = 2b (mol)
Mà: Acit dư nên theo PT: nH2SO4 (pư) = 1/2nNaOH = b (mol)
Ta có: nH2SO4 (dư) = 0,1.5 = 0,5 (mol)
⇒ b + 0,5 = 3a (1)
- TN2:
nH2SO4 = 2a (mol), nNaOH = 3b (mol)
Mà: Base dư nên theo PT: nNaOH (pư) = 2nH2SO4 = 4a (mol)
Ta có: nNaOH (dư) = 0,1.5 = 0,5 (mol)
⇒ 4a + 0,5 = 3b (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,4\left(M\right)\\b=0,7\left(M\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
cảm ơn trước ạ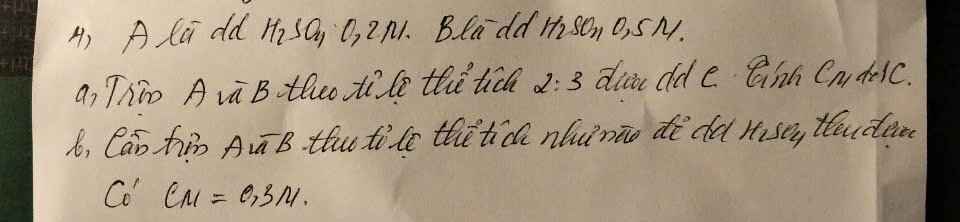
Bài 4:
a, Gọi: VA = 2a (l) → VB = 3a (l)
⇒ nH2SO4 = 2a.0,2 + 3a.0,5 = 1,9a (mol)
\(\Rightarrow C_{M\left(C\right)}=\dfrac{1,9a}{2a+3a}=0,38\left(M\right)\)
b, Gọi: VA = x (mol), VB = y (l)
⇒ nH2SO4 = 0,2x + 0,5y (mol)
\(\Rightarrow\dfrac{0,2x+0,5y}{x+y}=0,3\)
\(\Rightarrow\dfrac{V_A}{V_B}=\dfrac{x}{y}=\dfrac{2}{1}\)
→ Trộn A và B theo tỉ lệ 2:1
Đúng 1
Bình luận (0)
;>
Bài 3:
Ta có: mNaOH (A) = 500.10% = 50 (g)
a, \(C\%=\dfrac{50}{500+100}.100\%\approx8,33\%\)
b, \(C\%_B=\dfrac{50+5}{500+5}.100\%\approx10,89\%\)
c, \(C\%_C=\dfrac{50}{400}.100\%=12,5\%\)
d, mNaOH (thêm vào) = 300.15% = 45 (g)
\(\Rightarrow C\%_D=\dfrac{50+45}{500+300}.100\%=11,875\%\)
Đúng 1
Bình luận (0)
giúp với ạ
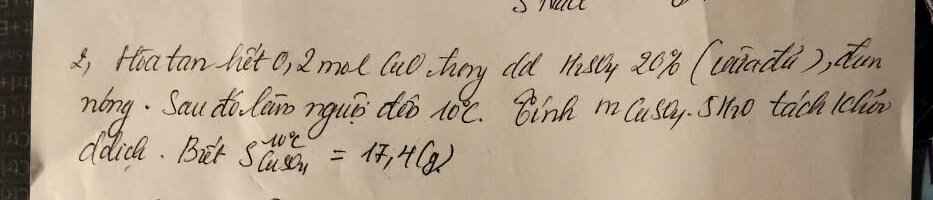
\(CuO+H_2SO_4=CúSO_4+H_2O\)
Theo phương trình phản ứng ta có :
\(n_{H_2SO_4}=n_{CuO}=n_{CuSO_4}=n_{H_2O}=0,2\left(mol\right)\)
\(C\%\left(H_2SO_4\right)=\dfrac{m_{ct}}{m_{dd}\left(H_2SO_4\right)}.100\%\)
\(\Rightarrow m_{dd}\left(H_2SO_4\right)=\dfrac{m_{ct}}{C\%\left(H_2SO_4\right)}.100\%=\dfrac{0,2.98}{0,2}=98\left(g\right)\)
\(m_{CuSO_4}=0,2.160=32\left(g\right)\)
\(m\left(dd.sau.Pu\right)=0,2.18+98=114\left(g\right)\)
Ở \(10^{oC}\) , cứ \(100\left(g\right)H_2O\) hòa tan được \(17,4\left(g\right)CuSO_4\)
Đặt \(x\left(mol\right)CuSO_4.5H_2O\) tách ra thì dung dịch lúc này gồm :
\(32-160x\left(g\right)CuSO_4\) và \(82-90x\left(g\right)H_2O\)
\(\Rightarrow17,4.\left(82-90x\right)=100.\left(32-160x\right)\)
\(\Rightarrow x=0,12\left(mol\right)\)
\(m_{CuSO_4.5H_2O}=\left(160+90\right)x=30\left(g\right)\)
Đúng 1
Bình luận (0)
ai giúp em với ạ