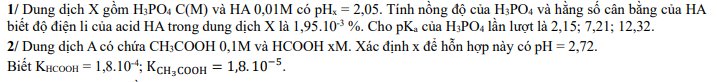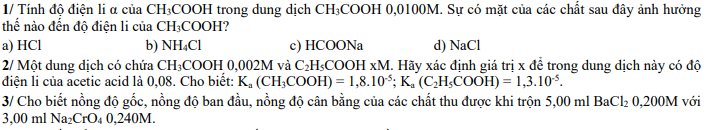Viết biểu thức điều kiện proton đối với các dung dịch sau:
a) Dung dịch CH3COOH
b) Dung dịch HNO3 và NaHSO4
c) Dung dịch KOH và NH3
d) Dung dịch CH3COOH C1 (mol/l) và CH3COONa C2 (mol/l)
e) Dung dịch Na2SO3
f) Dung dịch NaHCO3
g) Dung dịch H2SO4 C (mol/l)