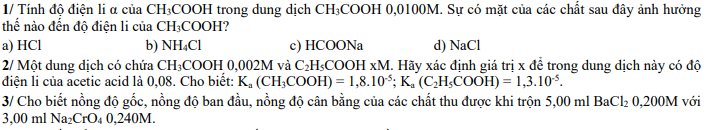1)
Cân bằng trong dung dịch:
\(CH_3COOH⇌CH_3COO^-+H^+\) \(K_a=10^{-4,75}\)
\(K_a=\dfrac{C_0\alpha^2}{1-\alpha}\Rightarrow\alpha^2+\dfrac{K_a}{C_0}\alpha-\dfrac{K_a}{C_0}=0\)
\(\Rightarrow\alpha^2+10^{-2,75}\alpha-10^{2,75}=0\Rightarrow\alpha=0,0413\)
a)
\(HCl\rightarrow H^++Cl^-\)
\(CH_3COOH⇌CH_3COO+H^+\left(1\right)\)
\(\alpha=\dfrac{\left|CH_3COO^-\right|}{C_0}\) Khi có mặt HCl thì nồng độ \(H^+\) tăng => độ điện li $\alpha $ giảm.
b)
\(CH_3COOH⇌CH_3COO^-+H^+\left(1\right)\\ NH_4^+⇌NH_3+H^+\left(2\right)\)
Nếu \(K_{NH_4^+}C_{NH_3}< < K_{CH_3COOH}C_{CH_3COOH}\) thì lượng \(H^+\) sinh ra do (2) không đáng kể so với lượng \(H^+\) sinh ra do (1). Tức (2) không ảnh hưởng đến (1)
=> $\alpha $ không đổi
2)
Nồng độ \(CH_3COOH\) bị phân li thành ion: \(0,002.0,08=1,6.10^{-4}\)
\(CH_3COOH⇌CH_3COO^-+H^+\) (1)
C 0,002
[ ] \(\left(1.10^{-3}-1,6.10^{-4}\right)\) \(1,6.10^{-4}\) \(\left(1,6.10^{-4}+\alpha x\right)\)
\(C_2H_5COOH⇌C_2H_5COO^-+H^+\left(2\right)\)
C x
[ ] \(\left(1-\alpha\right)x\) \(\alpha x\) \(\left(1,6.10^{-4}+\alpha x\right)\)
(1)\(\Rightarrow K_a\left(CH_3COOH\right)=\dfrac{1,6.10^{-4}\left(\alpha x+1,6.10^{-4}\right)}{\left(2.10^{-3}-1,6.10^{-4}\right)}=1,8.10^{-5}\Rightarrow\alpha x=4,7.10^{-5}\left(3\right)\)
(2) \(\Rightarrow K_a\left(C_2H_5COOH\right)=\dfrac{\alpha\left(\alpha x+1,6.10^{-4}\right)}{\left(1-\alpha\right)}=1,3.10^{-5}\left(4\right)\)
Thế \(\alpha x\) từ (3) vào (4) \(\Rightarrow\alpha=0,0591\Rightarrow x=79,52.10^{-5}M\)
3)
Nồng độ gốc \(C_0:BaCl_2\) \(0,200M;Na_2CrO_4\) \(0,240M\)
Nồng độ ban đầu: \(C_{BaCl_2}^0=\dfrac{0,2.5}{8}=0,125M;C_{Na_2CrO_4}^0=\dfrac{0,24.3}{8}=0,090M\)
\(BaCl_2\rightarrow Ba^{2+}+2Cl^-\)
0,125 0,125 0,25
\(Na_2CrO_4\rightarrow2Na^++CrO_4^{2-}\)
0,09 0,18 0,09
\(Ba^{2+}+CrO_4^{2-}\rightarrow BaCrO_4\downarrow\)
\(C^0\) 0,125 0,09
C 0,035
Vì \(BaCrO_4\) rất ít tan, trong khi hệ có \(Ba^{2+}\) dư nên có thể coi độ tan của \(BaCrO_4\) là không đáng kể. Vì vậy:
\(\left[Ba^{2+}\right]=0,035M;\left[Cl^-\right]=0,250M;\left[Na^+\right]=0,180M\)