Chỉ dùng 1 thuốc thử, trình bày cách nhận biết các chất rắn riêng biệt sau: Na2CO3; Na2SO4; KCl; H2SO4; HCl
Bài 18. Nhôm
_Trích mẫu thử, đánh STT_
- Cho các mẫu thử lần lượt tác dụng với nhau, ta có KQ ở bảng sau:
| Na2CO3 | Na2SO4 | KCl | H2SO4 | HCl | |
| Na2CO3 | \ | x | x | Có khí không màu, không mùi | Có khí không màu, không mùi |
| Na2SO4 | x | \ | x | x | x |
| KCl | x | x | \ | x | x |
| H2SO4 | Có khí không màu, không mùi | x | x | \ | x |
| HCl | Có khí không màu, không mùi | x | x | x | \ |
Từ KQ bảng trên, nhận xét:
- Mẫu thử có 2 khí không màu, không mùi => Na2CO3
- Mẫu thử không có hiện tượng => Na2SO4, KCl (1)
- Mẫu thử có 1 khí không màu, không mùi => HCl, H2SO4 (2)
- Cho dd BaCl2 vào các mẫu thử (1):
+ Có kết tủa trắng: Na2SO4
\(Na_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2NaCl\)
+ Không hiện tượng: KCl
- Cho BaCl2 vào các mẫu thử (2):
+ Có kết tủa trắng: H2SO4
\(H_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2HCl\)
+ Không hiện tượng: HCl
_Dán nhãn_
Đúng 1
Bình luận (0)
Viết PTHH
a, Al-->Al2O3-->AlCl3-->Al(OH)3-->Al203-->Al
"(AlCl3-->Al(NO3)3
b, Fe-->Fe3O4-->FeCl3-->Fe(OH)3-->Fe2O3-->Fe
c, Fe(OH)3-->Fe2(SO4)3-->FeCl3-->Fe(NO3)3
\(a,4Al+3O_2\xrightarrow[t^0]{}2Al_2O_3\\ Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\\ AlCl_3+3AgNO_3\rightarrow Al\left(NO_3\right)_3+3AgCl\\ AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3+3NaCl\\ 2Al\left(OH\right)_3\xrightarrow[t^0]{}Al_2O_3+3H_2O\\ 2Al_2O_3\xrightarrow[đpnc]{criolit}4Al+3O_2\\ b,3Fe+2O_2\xrightarrow[t^0]{}Fe_3O_4\\ Fe_3O_4+8HCl\rightarrow2FeCl_3+FeCl_2+4H_2O\\ FeCl_3+3NaOH\rightarrow Fe\left(OH\right)_3+3NaCl\\ 2Fe\left(OH\right)_3\xrightarrow[t^0]{}Fe_2O_3+3H_2O\\ Fe_2O_3+3CO\xrightarrow[t^0]{}2Fe+3CO_2\)
\(c,2Fe\left(OH\right)_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+6H_2O\\ Fe_2\left(SO_4\right)_3+3BaCl_2\rightarrow2FeCl_3+3BaSO_4\\ FeCl_3+AgNO_3\rightarrow Fe\left(NO_3\right)_3+3AgCl\)
Đúng 2
Bình luận (0)
Hấp thụ hoàn toàn 0,3 mol CO2 vào dung dịch X chứa KOH và K2CO3 thu được dung dịch Y chứa 2 chất tan. Nhỏ từ từ đến hết dung dịch Y vào 450ml dung dịch HCl 1M, sau khi kết thúc phản ứng thu được dung dịch Z và 0,36 mol khí. Mặt khác, nếu cho toàn bộ dung dịch Y tác dụng với lượng dư dung dịch Ba(OH)2 thì thu được 118,2 gam kết tủa. Xác định số mol các chất trong dung dịch X
\(n_{BaCO_3}=\dfrac{118,2}{197}=0,6\left(mol\right);n_{HCl}=0,45.1=0,45\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{K_2CO_3}=a\left(mol\right)\\n_{KOH}=b\left(mol\right)\end{matrix}\right.\)
Sơ đồ phản ứng:
\(\left\{{}\begin{matrix}K_2CO_3:a\\KOH:b\end{matrix}\right.+CO_2:0,3\rightarrow Y\left\{{}\begin{matrix}KHCO_3\\K_2CO_3\end{matrix}\right.+\left[{}\begin{matrix}HCl:0,45\rightarrow CO_2:0,36\\Ba\left(OH\right)_{2\left(dư\right)}\rightarrow BaCO_3:0,6\end{matrix}\right.\)
Ta thấy:
nC (trong CO2 sinh ra từ HCl) < nC (trong BaCO3 sinh ra từ Ba(OH)2 dư)
=> HCl hết, 2 muối có thể dư
Theo BTNT C: \(a=n_{K_2CO_3}=n_{BaCO_3}-n_{CO_2}=0,6-0,3=0,3\left(mol\right)\)
Đặt \(\left\{{}\begin{matrix}n_{K_2CO_3\left(pứ\right)}=x\left(mol\right)\\n_{KHCO_3\left(pứ\right)}=y\left(mol\right)\end{matrix}\right.\)
BTNT C: x + y = 0,36 (*)
BTNT K: \(n_{KCl}=2n_{K_2CO_3}+n_{KHCO_3}=2x+y\left(mol\right)\)
BTNT Cl: \(n_{HCl}=n_{KCl}\Rightarrow2x+y=0,45\) (**)
Từ (*), (**) => \(\left\{{}\begin{matrix}x=0,09\\y=0,27\end{matrix}\right.\)
=> \(n_{K_2CO_3}:n_{KHCO_3}=x:y=0,09:0,27=1:3\)
BTNT C: \(n_{K_2CO_3}+n_{KHCO_3}=n_{BaCO_3}=0,6\left(mol\right)\)
=> \(\left\{{}\begin{matrix}n_{K_2CO_3}=0,15\left(mol\right)\\n_{KHCO_3}=0,45\left(mol\right)\end{matrix}\right.\)
BTNT K: \(n_{KOH}+2n_{K_2CO_3}=2n_{K_2CO_3}+n_{KHCO_3}\)
=> \(b=n_{KOH}=2.0,15+0,45-0,3.2=0,15\left(mol\right)\)
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 13,3 g hỗn hợp X gồm một kim loại kiềm A, Al và Fe bằng dung dịch H2SO4 29,4% vừa đủ thu được 10,08 lít H2 (đktc) và dung dịch Y. Cho dung dịch Y tác dụng với dung dịch Ba(OH)2 34,2% cho tới khi gốc sunfat kết tủa vừa hết thì thu được dung dịch E và kết tủa F. Lọc lấy kết tủa F đem nung trong không khí tới khối lượng không đổi thu được 117,95 g chất rắn.
1) Xác định kim loại A. Biết rằng trong hỗn hợp X tỉ lệ số mol của Al và Fe tương ứng là 2:1.
2) Tính thành phần phần trăm...
Đọc tiếp
Hòa tan hoàn toàn 13,3 g hỗn hợp X gồm một kim loại kiềm A, Al và Fe bằng dung dịch H2SO4 29,4% vừa đủ thu được 10,08 lít H2 (đktc) và dung dịch Y. Cho dung dịch Y tác dụng với dung dịch Ba(OH)2 34,2% cho tới khi gốc sunfat kết tủa vừa hết thì thu được dung dịch E và kết tủa F. Lọc lấy kết tủa F đem nung trong không khí tới khối lượng không đổi thu được 117,95 g chất rắn. 1) Xác định kim loại A. Biết rằng trong hỗn hợp X tỉ lệ số mol của Al và Fe tương ứng là 2:1. 2) Tính thành phần phần trăm khối lượng các chất có trong hỗn hợp X. 3) Tính nồng độ phần trăm các chất có trong dung dịch E.
Nhỏ từ từ dung dịch Ba(OH)2 đến dư vào dung dịch hỗn hợp Al2(SO4)3 và Na2SO4 ta có đồ thị biểu diễn sự phụ thuộc khối lượng kết tủa theo số mol Ba(OH)2 như sau. Tìm x, t? (P/s: Làm theo phương trình giúp mình nhé!)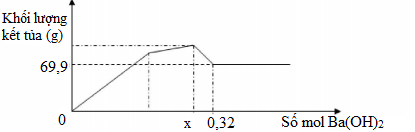
Cho 6,75g kim loại của nhôm tác dụng với 196g dd axit sufuric 15% . Tính thể tích khí hiđro thoát ra ở đktc
Vì sao Mg không thể làm sạch AlCl3 bị lẫn tạp chất CuCl2 ?
vì khi đó AlCl3 bị lẫn tạp chất MgCl2.
Cách đúng cho bột Al vào dd, lọc bỏ phần rắn không tan thu được dd AlCl3
2Al + 3CuCl2 → 2AlCl3 + 3Cu↓
Đúng 0
Bình luận (0)
Hòa tan hết m gam hỗn hợp X gồm Na, Na2O, K, K2O, Ba, BaO (trong X, oxi chiếm 8,75% về khối lượng) vào nước, thu được 400 ml dung dịch Y và 1,568 lít H2 (đktc). Trộn 200 ml dung dịch Y với 200 ml dung dịch Z gồm HCl 0,2M và H2SO4 0,15M thu được 400 ml dung dịch T. Để trung hòa vừa hết dung dịch T cần phải thêm 40ml dung dịch HNO3 1M. Các phản ứng xảy ra hoàn toàn. a) Tính m. b) Nếu cô cạn 400ml dung dịch Y thì thu được bao nhiêu gam chất rắn khan?
Đọc tiếp
Hòa tan hết m gam hỗn hợp X gồm Na, Na2O, K, K2O, Ba, BaO (trong X, oxi chiếm 8,75% về khối lượng) vào nước, thu được 400 ml dung dịch Y và 1,568 lít H2 (đktc). Trộn 200 ml dung dịch Y với 200 ml dung dịch Z gồm HCl 0,2M và H2SO4 0,15M thu được 400 ml dung dịch T. Để trung hòa vừa hết dung dịch T cần phải thêm 40ml dung dịch HNO3 1M. Các phản ứng xảy ra hoàn toàn. a) Tính m. b) Nếu cô cạn 400ml dung dịch Y thì thu được bao nhiêu gam chất rắn khan?
Nhỏ từ từ dung dịch Ba(OH)2 vào dung dịch chứa đồng thời HCl và Al2(SO4)3. Khối lượng kết tủa phụ thuộc vào số mol Ba(OH)2 được biểu diễn như hình sau. Tìm tổng (x+y). (Làm theo phương trình hóa học giúp mình nhé!)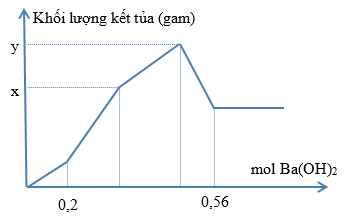
Đoạn OA :
\(Ba\left(OH\right)_2+2HCl\text{→}BaCl_2+2H_2O\)
0,2 0,2 (mol)
\(3BaCl_2+Al_2\left(SO_4\right)_3\text{→}3BaSO_4+2AlCl_3\)
0,2 0,6 \(\dfrac{0,4}{3}\) (mol)
Đoạn AB :
\(3Ba\left(OH\right)_2+Al_2\left(SO_4\right)_3\text{→}3BaSO_4+2Al\left(OH\right)_3\)
3a 3a 2a (mol)
Đoạn BC :
\(2AlCl_3+3Ba\left(OH\right)_2\text{→}2Al\left(OH\right)_3+3BaCl_2\)
\(\dfrac{0,4}{3}\) 0,2 \(\dfrac{0,4}{3}\) (mol)
Đoạn CD :
\(2Al\left(OH\right)_3+Ba\left(OH\right)_2\text{→}Ba\left(AlO_2\right)_2+4H_2O\)
(\(\dfrac{0,4}{3}\)+2a) (\(\dfrac{0,2}{3}\) + a) (mol)
$\Rightarrow n_{Ba(OH)_2} = 0,2 + 3a + 0,2 + \dfrac{0,2}{3} + a = 0,56 \Rightarrow a = \dfrac{7}{300}$
Suy ra:
$x = 0,6.233 + 3a.233 + 2a.78 = 139,8 + 855a = 159,75(gam)$
$y = x + \dfrac{0,4}{3}.78 = 170,15(gam)$
Đúng 1
Bình luận (0)
Cho 2 dung dịch: dung dịch A (Al2(SO4)3) và dung dịch B (NaOH) đều chưa biết nồng độ. - TN1: Trộn 100ml dung dịch A với 120ml dung dịch B, được kết tủa, sau khi nung được chất rắn có khối lượng 2,04 gam. - TN2: Trộn 100ml dung dịch A với 200ml dung dịch B, lấy kết tủa đem nung ta được 2,04 gam chất rắn. a) Chứng tỏ rằng trong TN1, Al(OH)3 chưa tan trở lại, xác định nồng độ mol của 2 dung dịch A và B. b) Phải thêm vào 100ml dung dịch A bao nhiêu ml dung dịch B để cho chất rắn thu được sau khi nun...
Đọc tiếp
Cho 2 dung dịch: dung dịch A (Al2(SO4)3) và dung dịch B (NaOH) đều chưa biết nồng độ. - TN1: Trộn 100ml dung dịch A với 120ml dung dịch B, được kết tủa, sau khi nung được chất rắn có khối lượng 2,04 gam. - TN2: Trộn 100ml dung dịch A với 200ml dung dịch B, lấy kết tủa đem nung ta được 2,04 gam chất rắn. a) Chứng tỏ rằng trong TN1, Al(OH)3 chưa tan trở lại, xác định nồng độ mol của 2 dung dịch A và B. b) Phải thêm vào 100ml dung dịch A bao nhiêu ml dung dịch B để cho chất rắn thu được sau khi nung kết tủa có khối lượng 1,224 gam.
a) Dù dùng $V_{dd\ B\ ở\ TN2} > V_{dd\ B\ ở\ TN1}$ mà lượng kết tủa thu được vẫn bằng nhau. Suy ra : ở TN1, kết tủa chưa đạt tối đa, tức là $Al(OH)3$ chưa bị hòa tan trở lại.
Gọi $C_{M_A} = a(M) ; C_{M_B} = b(M)$
$n_{Al_2O_3} = 0,02 \Rightarrow n_{Al(OH)_3} = 0,04(mol)$
TH1 :
$Al_2(SO_4)_3 + 6NaOH \to 2Al(OH)_3 + 3Na_2SO_4$
$n_{Al_2(SO_4)_3} = \dfrac{1}{2}n_{Al(OH)_3} = 0,06(mol) \Rightarrow ba= \dfrac{0,06}{0,1} = 0,6M$
TN2 :
\(Al_2\left(SO_4\right)_3+6NaOH\text{→}2Al\left(OH\right)_3+3Na_2SO_4\)
0,06 0,36 0,12 (mol)
\(Al\left(OH\right)_3+NaOH\text{→}NaAlO_2+2H_2O\)
0,08 0,08 (mol)
$\Rightarrow n_{NaOH} = 0,36 + 0,08 = 0,44(mol) \Rightarrow b =\dfrac{0,44}{0,2} = 2,2M$
b)
$n_{Al_2O_3} = 0,012(mol) \Rightarrow n_{Al(OH)_3} = 0,024(mol)$
\(Al_2\left(SO_4\right)_3+6NaOH\text{→}2Al\left(OH\right)_3+3Na_2SO_4\)
0,06 0,36 0,12 (mol)
\(Al\left(OH\right)_3+NaOH\text{→}NaAlO_2+2H_2O\)
0,096 0,096 (mol)
$n_{NaOH} = 0,36 + 0,096 = 0,456 \Rightarrow V_{dd\ B} =\dfrac{0,456}{2,2} = 0,207(lít)$
Đúng 1
Bình luận (1)












