Nhỏ từ từ dung dịch Ba(OH)2 vào ống nghiệm chứa dung dịch HCl (a mol) và Al2(SO4)3 (b mol). Đồ thị biểu diễn sự phụ thuộc khối lượng kết tủa theo thể tích dung dịch Ba(OH)2 như sau. Tính giá trị của a:b? ( trình bày chi tiết giúp em theo pthh với!)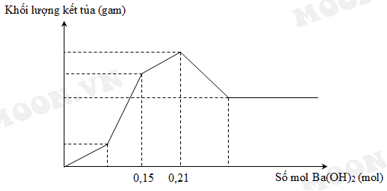
Bài 18. Nhôm
Hòa tan hoàn toàn 16,6g hỗn hợp cùng Na và Ca vào H2O thu được 8,96l khí H2 (đktc)
a) Tính khối lượng từng kim loại trong hỗn hợp ban đầu
b)Tính khối lượng các bazơ tạo thành
a, PT: \(2Na+2H_2O\rightarrow2NaOH+H_2\)
\(Ca+2H_2O\rightarrow Ca\left(OH\right)_2+H_2\)
Gọi: \(\left\{{}\begin{matrix}n_{Na}=x\left(mol\right)\\n_{Ca}=y\left(mol\right)\end{matrix}\right.\)
⇒ 23x + 40y = 16,6 (1)
Ta có: \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Theo PT: \(n_{H_2}=\dfrac{1}{2}n_{Na}+n_{Ca}=\dfrac{1}{2}x+y=0,4\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,3\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Na}=0,2.23=4,6\left(g\right)\\m_{Ca}=0,3.40=12\left(g\right)\end{matrix}\right.\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{NaOH}=n_{Na}=0,2\left(mol\right)\\n_{Ca\left(OH\right)_2}=n_{Ca}=0,3\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{NaOH}=0,2.40=8\left(g\right)\\m_{Ca\left(OH\right)_2}=0,3.74=22,2\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Dẫn khí H2 dư đi qua hỗn hợp A gồm CuO, Fe2O3, K2O, Al2O3, MgO nung nóng, sau phản ứng thu được hỗn hợp rắn B. Cho hỗn hợp B vào dung dịch Ba(OH)2, sau phản ứng hoàn toàn thu được dung dịch C (chứa 2 chất tan) và chất rắn D. Sục khí CO2 dư vào dung dịch C thì thu được kết tủa G. Cho D vào dung dịch H2SO4 đặc, nóng thì được dung dịch E, khí F mùi hắc và chất rắn chứa 1 kim loại. Xác định thành phần A, B, C, D, F, G và viết phương trình xảy ra.
Đọc tiếp
Dẫn khí H2 dư đi qua hỗn hợp A gồm CuO, Fe2O3, K2O, Al2O3, MgO nung nóng, sau phản ứng thu được hỗn hợp rắn B. Cho hỗn hợp B vào dung dịch Ba(OH)2, sau phản ứng hoàn toàn thu được dung dịch C (chứa 2 chất tan) và chất rắn D. Sục khí CO2 dư vào dung dịch C thì thu được kết tủa G. Cho D vào dung dịch H2SO4 đặc, nóng thì được dung dịch E, khí F mùi hắc và chất rắn chứa 1 kim loại. Xác định thành phần A, B, C, D, F, G và viết phương trình xảy ra.
cho 5,4 g Al và 100ml dd H2SO4 0,5M . Thể tích H2 sinh ra (ở đktc) và nống độ mol của dd sau phản ứng là : ( giả sử thể tích dd thay đổi không đáng kể )
A. 1,12 lít và 0,17M B. 6,72 lít và 1,0M
C. 11,2 lít và 1,7M D . 67,2 lít và 1,7M
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\) ; \(n_{H_2SO_4}=0,5.0,1=0,05\left(mol\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
0,2 < 0,05 ( mol )
0,05 1/60 0,05 ( mol )
\(V_{H_2}=0,05.22,4=1,12\left(l\right)\)
\(C_{M_{Al_2\left(SO_4\right)_3}}=\dfrac{\dfrac{1}{60}}{0,1}=0,17\left(M\right)\)
`->` Chọn `A`
Đúng 3
Bình luận (0)
hoàn thành dãy chuyển đổi
Al2S3
^
Al2O3->Al->AlCl3->Al(OH)3
^
Al2O3->Al2(SO4)3->AlCl3
\(2Al_2O_3\xrightarrow[Criolit]{đpnc}4Al+3O_2\)
\(2Al+3S\xrightarrow[]{t^o}Al_2S_3\)
`2Al + 6HCl -> 2AlCl_3 + 3H_2`
`AlCl_3 + 3KOH -> Al(OH)_3 + 3KCl`
\(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
`Al_2O_3 + 3H_2SO_4 -> Al_2(SO_4)_3 + 3H_2O`
`Al_2(SO_4)_3 + 3BaCl_2 -> 2AlCl_3 + 3BaSO_4`
Đúng 1
Bình luận (0)
Cho 86,3 gam hỗn hợp X gồm Na, K, Ba và Al2O3 ( trong đó oxi chiếm 19,47% về khối lượng) tan hết vào nước, thu được dung dịch Y và 13,44 lít khí H2 ( đktc). Cho V lít dd HCl 2M vào dd, sau khi các phản ứng xảy ra hoàn toàn thu được 46,8 gam kết tủa. Tính thể tích dd HCl đã dùng.
$n_O = \dfrac{86,3.19,47\%}{16} = 1,05(mol)$
Coi hỗn hợp gồm $Na(a\ mol) , Al(b\ mol)$ và O(1,05 mol)
Ta có :
$23a + 27b + 1,05.16 = 86,3(1)$
Bảo toàn electron : $n_{Na} + 3n_{Al} = 2n_O + 2n_{H_2}$
$\Rightarrow a + 3b = 1,05.2 + 0,6.2(2)$
Từ (1)(2) suy ra $a = \dfrac{199}{70} ; b = \dfrac{16}{105}$
Suy ra Y gồm :
$AlO_2^- : \dfrac{16}{105}(mol)$
$Na^+ : \dfrac{199}{70}(mol)$
$OH^- : \dfrac{199}{70} - \dfrac{16}{105} = \dfrac{113}{42}(mol)$
$n_{Al(OH)_3} = \dfrac{46,8}{78} = 0,6(mol)$
Suy ra :
$n_{HCl} = n_{H^+} = n_{OH^-} + 4n_{AlO_2^-} - 3n_{Al(OH)_3} = 1,5(mol)$
$V_{dd\ HCl} = \dfrac{1,5}{2} = 0,75(lít)$
Đúng 1
Bình luận (0)
Cho 6,75g kim loại của nhôm tác dụng với 196g dd axit sufuric 15% . Tính thể tích khí hiđro thoát ra ở đktc
Vì sao Mg không thể làm sạch AlCl3 bị lẫn tạp chất CuCl2 ?
vì khi đó AlCl3 bị lẫn tạp chất MgCl2.
Cách đúng cho bột Al vào dd, lọc bỏ phần rắn không tan thu được dd AlCl3
2Al + 3CuCl2 → 2AlCl3 + 3Cu↓
Đúng 0
Bình luận (0)
Hòa tan hết m gam hỗn hợp X gồm Na, Na2O, K, K2O, Ba, BaO (trong X, oxi chiếm 8,75% về khối lượng) vào nước, thu được 400 ml dung dịch Y và 1,568 lít H2 (đktc). Trộn 200 ml dung dịch Y với 200 ml dung dịch Z gồm HCl 0,2M và H2SO4 0,15M thu được 400 ml dung dịch T. Để trung hòa vừa hết dung dịch T cần phải thêm 40ml dung dịch HNO3 1M. Các phản ứng xảy ra hoàn toàn. a) Tính m. b) Nếu cô cạn 400ml dung dịch Y thì thu được bao nhiêu gam chất rắn khan?
Đọc tiếp
Hòa tan hết m gam hỗn hợp X gồm Na, Na2O, K, K2O, Ba, BaO (trong X, oxi chiếm 8,75% về khối lượng) vào nước, thu được 400 ml dung dịch Y và 1,568 lít H2 (đktc). Trộn 200 ml dung dịch Y với 200 ml dung dịch Z gồm HCl 0,2M và H2SO4 0,15M thu được 400 ml dung dịch T. Để trung hòa vừa hết dung dịch T cần phải thêm 40ml dung dịch HNO3 1M. Các phản ứng xảy ra hoàn toàn. a) Tính m. b) Nếu cô cạn 400ml dung dịch Y thì thu được bao nhiêu gam chất rắn khan?
Nhỏ từ từ dung dịch Ba(OH)2 vào dung dịch chứa đồng thời HCl và Al2(SO4)3. Khối lượng kết tủa phụ thuộc vào số mol Ba(OH)2 được biểu diễn như hình sau. Tìm tổng (x+y). (Làm theo phương trình hóa học giúp mình nhé!)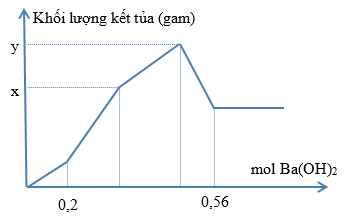
Đoạn OA :
\(Ba\left(OH\right)_2+2HCl\text{→}BaCl_2+2H_2O\)
0,2 0,2 (mol)
\(3BaCl_2+Al_2\left(SO_4\right)_3\text{→}3BaSO_4+2AlCl_3\)
0,2 0,6 \(\dfrac{0,4}{3}\) (mol)
Đoạn AB :
\(3Ba\left(OH\right)_2+Al_2\left(SO_4\right)_3\text{→}3BaSO_4+2Al\left(OH\right)_3\)
3a 3a 2a (mol)
Đoạn BC :
\(2AlCl_3+3Ba\left(OH\right)_2\text{→}2Al\left(OH\right)_3+3BaCl_2\)
\(\dfrac{0,4}{3}\) 0,2 \(\dfrac{0,4}{3}\) (mol)
Đoạn CD :
\(2Al\left(OH\right)_3+Ba\left(OH\right)_2\text{→}Ba\left(AlO_2\right)_2+4H_2O\)
(\(\dfrac{0,4}{3}\)+2a) (\(\dfrac{0,2}{3}\) + a) (mol)
$\Rightarrow n_{Ba(OH)_2} = 0,2 + 3a + 0,2 + \dfrac{0,2}{3} + a = 0,56 \Rightarrow a = \dfrac{7}{300}$
Suy ra:
$x = 0,6.233 + 3a.233 + 2a.78 = 139,8 + 855a = 159,75(gam)$
$y = x + \dfrac{0,4}{3}.78 = 170,15(gam)$
Đúng 1
Bình luận (0)



















