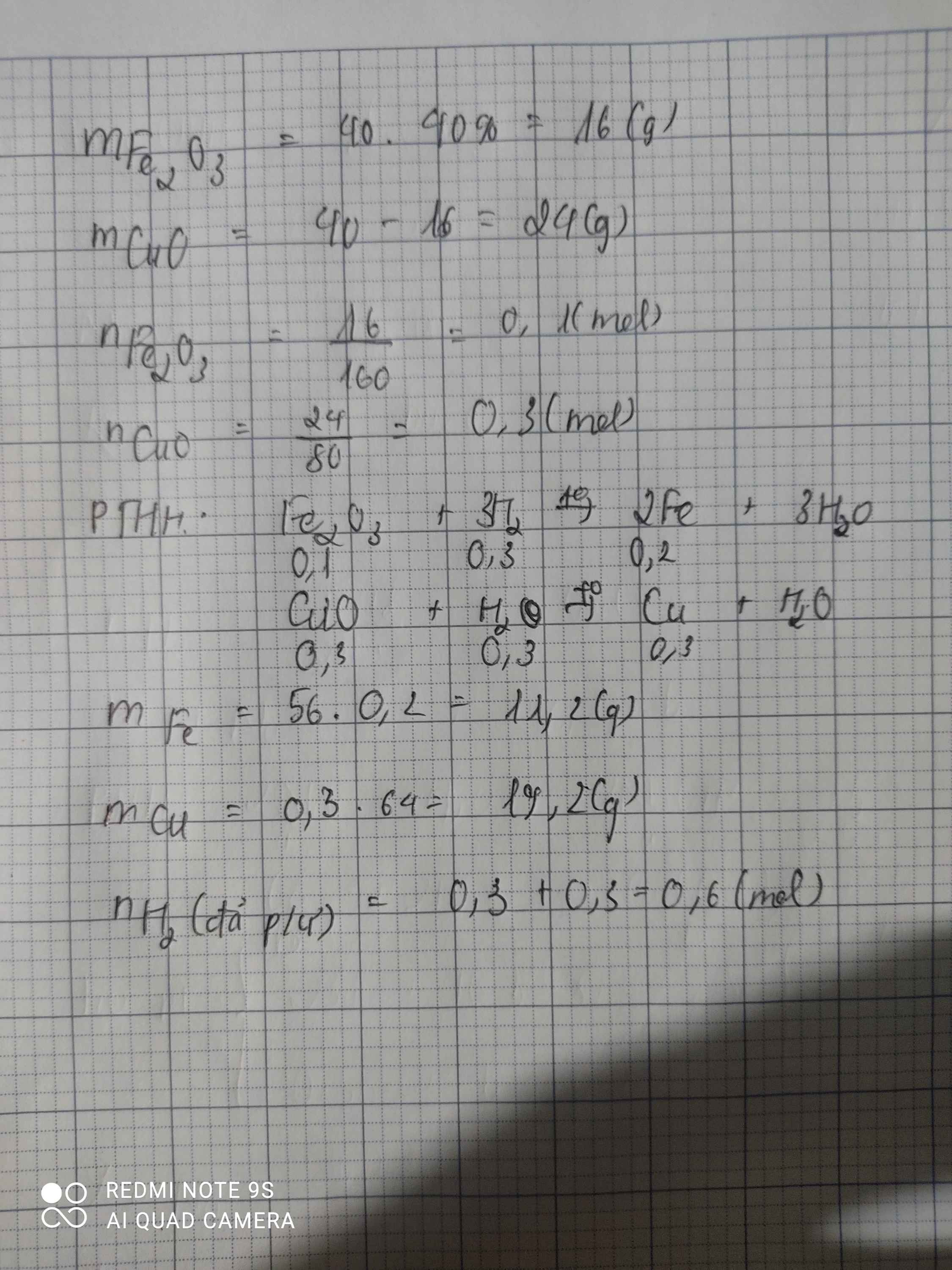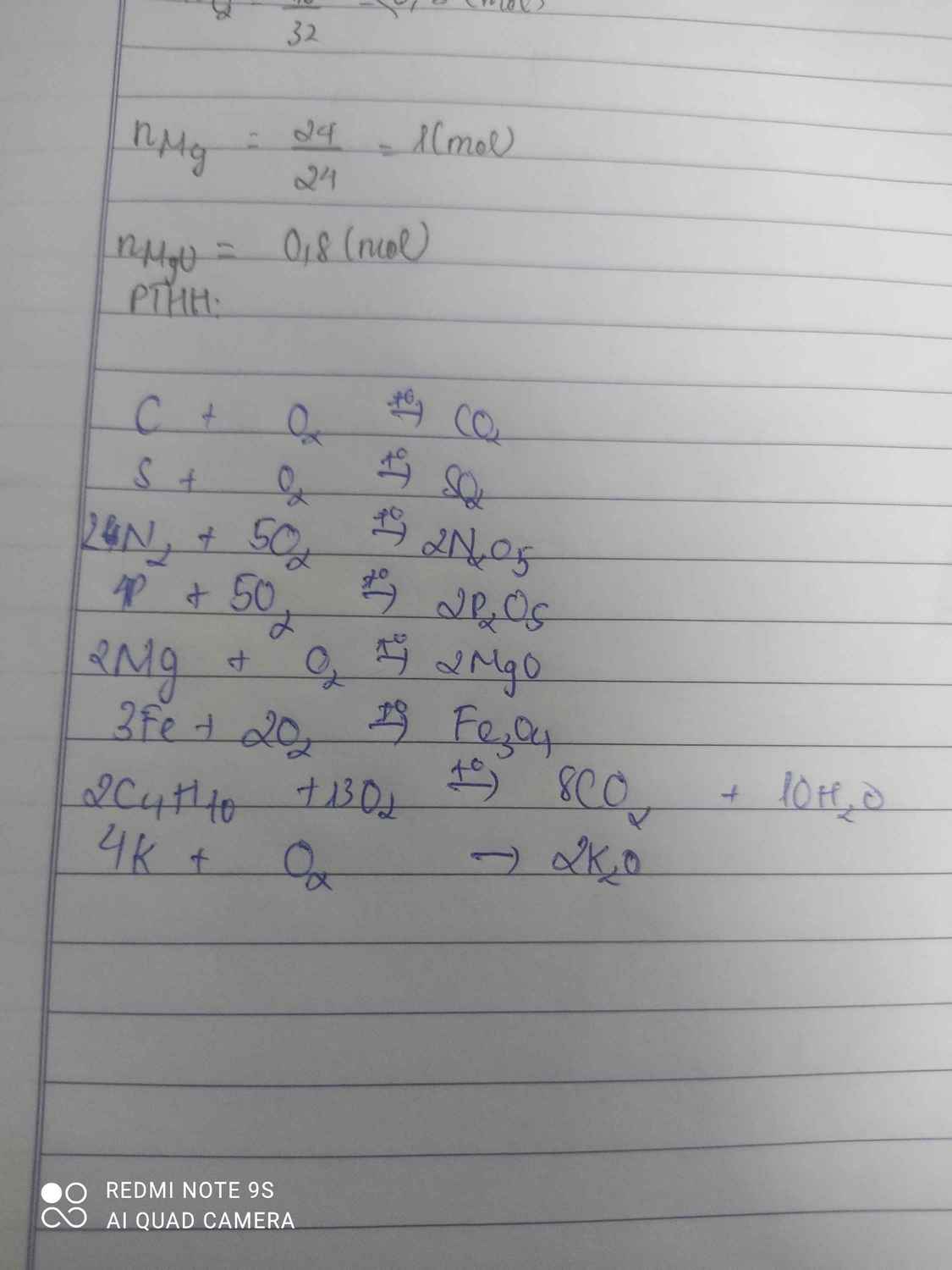nêu phương pháp phân biệt 2 bình chứa khí , k.o dán nhãn : O2 và H2
Bài 31: Tính chất - Ứng dụng của Hiđro
Ta thử tàn que đóm đang cháy:
H2 cháy với ngọn lửa xanh nhạt
O2 cháy với ngọn lửa mãnh liệt
Đúng 1
Bình luận (2)
có 40g hỗn hợp gồm 40% Fe2O3 và 60% CuO người ta dùng h2 ( dư) để khử hỗn hợp đó . a, Tính klg Fe và Cu thu đc sau phản ứng b, Tính số mol H2 đã tham gia phản ứng
Câu 3: Những phản ứng hóa học nào dưới đây có thể được dùng để điều chế hiđro trong phòng thí nghiệm?
a.Zn + 2HCl → ZnCl2 + H2
b.2H2O -->2H2 + O2
c.2Al + 3H2 SO4 → Al2(SO4)3+ 3H2O
d. a và c
PTHH c đáng ra sản phẩm không phải H2O mà là H2
=>Chọn A
Đúng 1
Bình luận (0)
cho các chất C, S, N, P, K, Mg, Fe, C4H10 tác dụng với oxi. Viết pthh xảy ra
\(C+O_2\rightarrow\left(t^o\right)CO_2\\ S+O_2\rightarrow\left(t^o\right)SO_2\\ 4K+O_2\rightarrow2K_2O\\ 3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\\ 4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\\ 2Mg+O_2\rightarrow\left(t^o\right)2MgO\\ 2C_4H_{10}+13O_2\rightarrow\left(t^o\right)8CO_2+10H_2O\)
N nguyên tử thường không phản ứng oxi. Mà Nito phân tử mới phản ứng với oxi.
Đúng 2
Bình luận (4)
Tính số gam nước thu được khi cho 8,96 lít khí hiđro tác dụng với 5,6 lít oxi (các thể tích đo ở đktc).
nH2 = V/22,4 = 8,96/22,4 = 0,4 (mol)
nO2 = V/22,4 = 5,6/22,4 = 0,25 (mol)
PTHH: 2H2 + O2 --to--> 2H2O
Ta có: 0,4/2 < 0,25/1
=> O2 dư
Theo PTHH: nH2O = nH2 = 0,4 (mol)
=> mH2O = n.M = 0,4 . 18 = 7,2(g)
Đúng 2
Bình luận (0)
Điện phân 1 lượng nước thu được khí hidro và oxi, nếu dùng lượng khí hiddro thu được để khử sắt(III)oxit thu được 16,8g sắt.Hỏi phải điện phân bao nhiêu lít nước,biết DH2OH2O=1g/ml?
Ứng dụng của hidro là:
Điều chế một số kim loại
Điều chế N\(H_3\)
Làm nhiên liệu
Tất cả các phương án trên
1/ khử 48 gam đồng (II) Oxit bằng khí hiđro.hãy
tính số gam đồng kim loại thu được
tính thể tích khí hiđro (đktc) cần dùng
2/ tính số gam nước thu được khi cho 8,4 lít khí hiđro tác dụng với 2,8 lít khí oxi (các thể tích khí đo ở đktc)
1/ \(CuO+H_2-^{t^o}\rightarrow Cu+H_2O\)
\(n_{Cu}=n_{CuO}=\dfrac{48}{80}=0,6\left(mol\right)\)
=> \(m_{Cu}=0,6.64=38,4\left(g\right)\)
\(n_{H_2}=n_{CuO}=0,6\left(mol\right)\)
=> \(V_{H_2}=0,6.22,4=13,44\left(l\right)\)
Đúng 3
Bình luận (0)
2. \(2H_2+O_2-^{t^o}\rightarrow2H_2O\)
\(n_{H_2}=0,375;n_{O_2}=0,125\)
Lập tỉ lệ \(\dfrac{0,375}{2}>\dfrac{0,125}{1}\)
=> Sau phản ứng H2 dư, tính theo số mol O2
\(n_{H_2O}=2n_{O_2}=0,25\left(mol\right)\)
=> \(m_{H_2O}=0,25.18=4,5\left(g\right)\)
Đúng 3
Bình luận (0)
Để khử hoàn toàn 62,4 gam hỗn hợp Fe2O3 và Fe3O4 cần vừa đủ 2,2 gam khí hiđro.
a) Tính khối lượng từng oxit trong hỗn hợp đầu.
b) Tính khối lượng Fe tạo thành sau phản ứng.
a)
Gọi $n_{Fe_2O_3} = a ; n_{Fe_3O_4} = b$
Ta có : $160a + 232b = 62,4(1)$
$Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O$
$Fe_3O_4 + 4H_2 \xrightarrow{t^o} 3Fe + 4H_2O$
$n_{H_2} = 3a + 4b = 2,2 :2 = 1,1(2)$
Từ (1)(2) suy ra a = 0,1 ; b = 0,2
$m_{Fe_2O_3} = 0,1.160 = 16(gam)$
$m_{Fe_3O_4} = 0,2.232 = 46,4(gam)$
b)
$n_{Fe} = 2a + 3b = 0,8(mol)$
$m_{Fe} = 0,8.56 = 44,8(gam)$
Đúng 3
Bình luận (0)
Hoà tan K vào nước thu được 2,24 lít khí H2 (đktc). Tính : a) khối lượng bazơ sinh ra b) Dùng lượng H2 trên khử 14,4 gam FeO. Tính khối lượng Fe tạo Thành ( biết K=39, H=1, O=16, Fe=56 )
a, Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PT: \(2K+2H_2O\rightarrow2KOH+H_2\)
__________________0,2____0,1 (mol)
⇒ mKOH = 0,2.56 = 11,2 (g)
b, PT: \(FeO+H_2\underrightarrow{t^o}Fe+H_2O\)
Ta có: \(n_{FeO}=\dfrac{14,4}{72}=0,2\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,1}{1}\), ta được FeO dư.
Theo PT: \(n_{Fe}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)