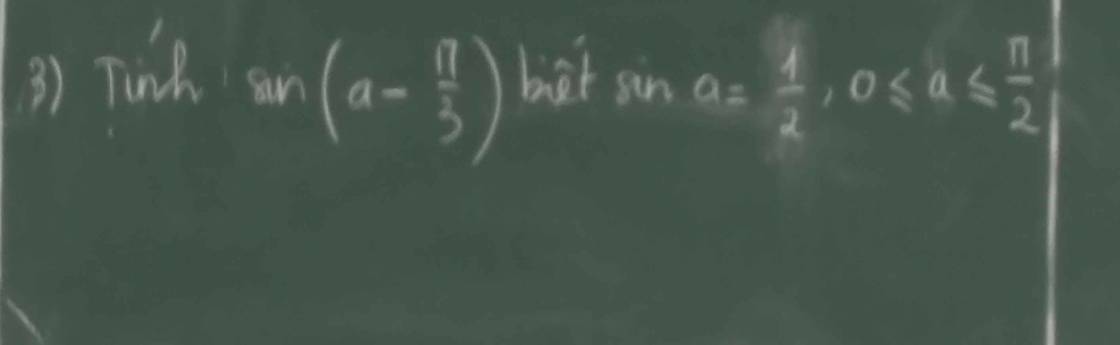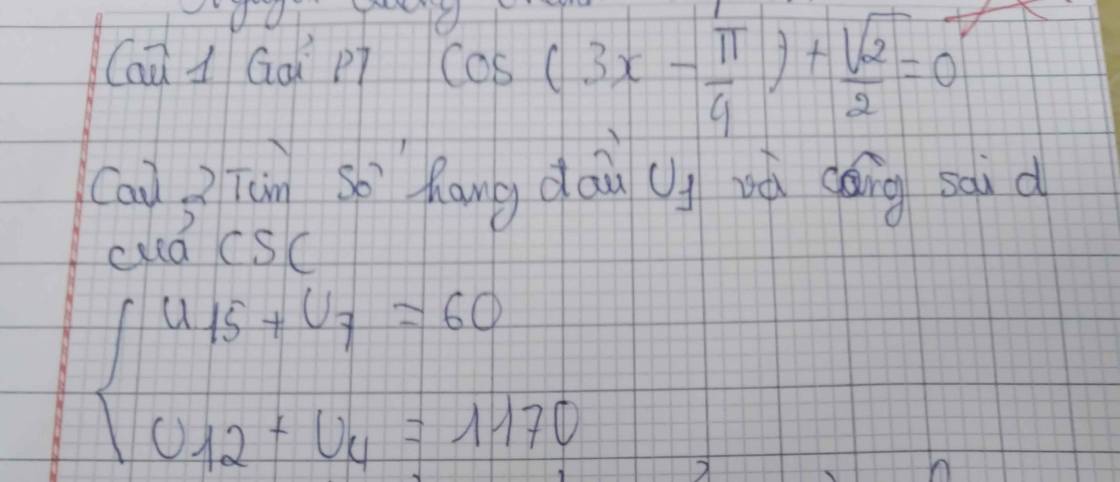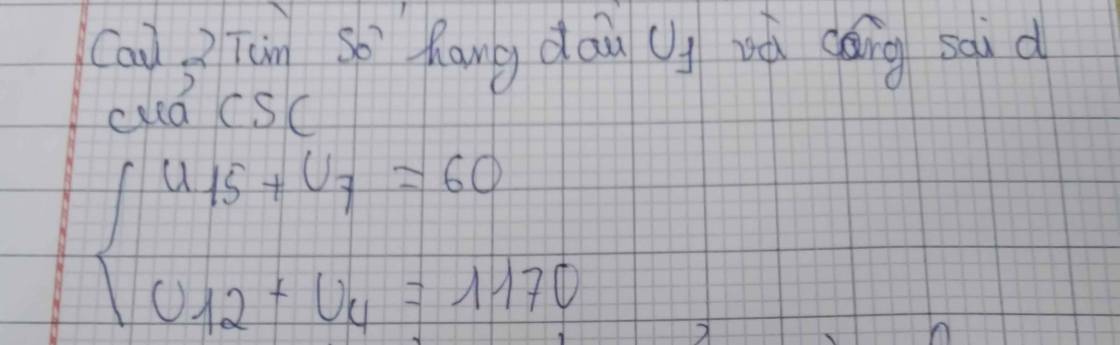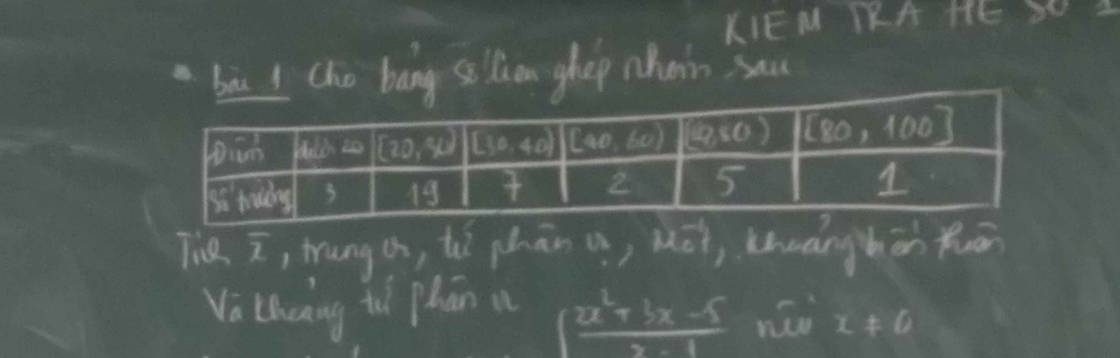ế đù mik cũng bên đó nick thật mik là kodo sinichi cơ nick đó ko cày đc e vì ko trl đc mik cày hộ thôi bn bên đó cho mik cái lick ạ
1. \(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
2. \(3K_2O+P_2O_5\rightarrow2K_3PO_4\)
3. \(CO_2+NaOH\rightarrow NaHCO_3\)
4. \(K_2O+2HCl\rightarrow2KCl+H_2O\)
5. \(FeO+H_2SO_4\rightarrow FeSO_4+H_2O\)
6. \(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
7. \(CuO+2HCl\rightarrow CuCl_2+H_2O\)
8. \(Fe+2HCl\rightarrow FeCl_2+H_2\)
9. \(3Mg+2H_3PO_4\rightarrow Mg_3\left(PO_4\right)_2+3H_2\)
10. \(3Cu+8HNO_3\rightarrow3Cu\left(NO_3\right)_2+2NO+4H_2O\)
11. \(Fe_3O_4+8HCl\rightarrow FeCl_2+2FeCl_3\)
12. \(Fe_3O_4+4H_2SO_4\rightarrow FeSO_4+Fe_2\left(SO_4\right)_3+4H_2O\)
13. \(2Fe_2\left(SO_4\right)_3+3O_2\xrightarrow[]{t^o}2Fe_2O_3+12SO_2\)
14. \(4FeS_2+11O_2\xrightarrow[]{t^o}2Fe_2O_3+8SO_2\)
15. \(4Fe\left(OH\right)_2+O_2+2H_2O\rightarrow4Fe\left(OH\right)_3\)
___________________________________________________________
49. \(NaOH+HCl\rightarrow NaCl+H_2O\)
50. \(Mg\left(OH\right)_2+2HCl\rightarrow MgCl_2+2H_2O\)
51. \(Al\left(OH\right)_3+3HCl\rightarrow AlCl_3+3H_2O\)
52. \(KOH+HNO_3\rightarrow KNO_3+H_2O\)
53. \(Cu\left(OH\right)_2+2HNO_3\rightarrow Cu\left(NO_3\right)_2+2H_2O\)
54. \(Fe\left(OH\right)_3+3HNO_3\rightarrow Fe\left(NO_3\right)_3+3H_2O\)
55. \(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)
56. \(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4\downarrow+2H_2O\)
57. \(2Fe\left(OH\right)_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+6H_2O\)
58. \(3NaOH+H_3PO_4\rightarrow Na_3PO_4+3H_2O\)
59. \(3Zn\left(OH\right)_2+2H_3PO_4\rightarrow Zn_3\left(PO_4\right)_2\downarrow+6H_2O\)
60. \(Al\left(OH\right)_3+H_3PO_4\rightarrow AlPO_4\downarrow+3H_2O\)
61. \(2NaOH+CuSO_4\rightarrow Cu\left(OH\right)_2\downarrow+Na_2SO_4\)
62. \(3KOH+AlCl_3\rightarrow Al\left(OH\right)_3\downarrow+3KCl\)
63. \(Ba\left(OH\right)_2+Na_2CO_3\rightarrow BaCO_3\downarrow+2NaOH\)
64. \(Ca\left(OH\right)_2+ZnSO_4\rightarrow CaSO_4\downarrow+Zn\left(OH\right)_2\downarrow\)
65. \(Ca\left(OH\right)_2+Fe\left(NO_3\right)_2\rightarrow Ca\left(NO_3\right)_2+Fe\left(OH\right)_2\downarrow\)
66. \(3Ba\left(OH\right)_2+2K_3PO_4\rightarrow Ba_3\left(PO_4\right)_2\downarrow+6KOH\)
67. \(HCl+AgNO_3\rightarrow AgCl\downarrow+HNO_3\)
68. \(2HCl+K_2SO_3\rightarrow2KCl+SO_2\uparrow+H_2O\)
69. \(2HCl+CaCO_3\rightarrow CaCl_2+CO_2\uparrow+H_2O\)
70. \(H_2SO_4+Ba\left(NO_3\right)_2\rightarrow BaSO_4\downarrow+2HNO_3\)
71. \(H_2SO_4+Na_2CO_3\rightarrow Na_2SO_4+CO_2\uparrow+H_2O\)
72. \(H_2SO_4+MgSO_3\rightarrow MgSO_4+SO_2\uparrow+H_2O\)
73. \(H_2SO_4+CaCl_2\rightarrow CaSO_4\downarrow+2HCl\)
74. \(2HNO_3+MgCO_3\rightarrow Mg\left(NO_3\right)_2+CO_2\uparrow+H_2O\)
75. \(2HNO_3+FeSO_3\rightarrow Fe\left(NO_3\right)_2+SO_2\uparrow+H_2O\)
76. \(3K_2CO_3+2H_3PO_4\rightarrow2K_3PO_4+3CO_2\uparrow+3H_2O\)
77. \(3CaSO_3+2H_3PO_4\rightarrow Ca_3\left(PO_4\right)_2\downarrow+3SO_2\uparrow+3H_2O\)
78. \(AgNO_3+NaCl\rightarrow AgCl\downarrow+NaNO_3\)
79. \(K_2SO_3+FeSO_4\rightarrow FeSO_3\downarrow+K_2SO_4\)
| Số thứ tự | CTHH của chất | Phận loại chất | Tên gọi của chất |
| 1 | NaOH | Bazơ tan | Natri hiđroxit |
| 2 | HCl | Axit không có oxit | Axit clohiđric |
| 3 | NaCl | Muối trung hoà | Natri clorua |
| 4 | H2O | Oxit trong tính | Nước |
| 5 | Mg(OH)2 | Bazơ không tan | Magie hiđroxit |
| 6 | MgCl2 | Muối trung hoà | Magie clorua |
| 7 | Al(OH)3 | Bazơ không tan | Nhôm hiđroxit |
| 8 | AlCl3 | Muối trung hoà | Nhôm clorua |
| 9 | KOH | Bazơ tan | Kali hiđroxit |
| 10 | KNO3 | Muối trung hoà | Kali nitrat |
| 11 | Cu(OH)2 | Bazơ không tan | Đồng (II) hiđroxit |
| 12 | Cu(NO3)2 | Muối trung hoà | Đồng (II) nitrat |
| 13 | Fe(OH)3 | Bazơ không tan | Sắt (III) hiđroxit |
| 14 | Fe(NO3)3 | Muối trung hoà | Sắt (III) nitrat |
| 15 | H2SO4 | Axit có oxi | Axit sunfuric |
| 16 | K2SO4 | Muối trung hoà | Kali sunfat |
| 17 | BaSO4 | Muối trung hoà | Bari sunfat |
| 18 | Fe2(SO4)3 | Muối trung hoà | Sắt (III) sunfat |
| 19 | H3PO4 | Axit có oxi | Axit photphoric |
| 20 | Na3PO4 | Muối trung hoà | Natri photphat |
| 21 | Zn(OH)2 | Bazơ không tan | Kẽm hiđroxit |
| 22 | Zn3(PO4)2 | Muối trung hoà | Kẽm photphat |
| 23 | AlPO4 | Muối trung hoà | Nhôm photphat |
| 24 | CuSO4 | Muối trung hoà | Đồng (II) photphat |
| 25 | Na2SO4 | Muối trung hoà | Natri sunfat |
| 26 | KCl | Muối trung hoà | Kali clorua |
| 27 | Na2CO3 | Muối trung hoà | Natri cacbonat |
| 28 | BaCO3 | Muối trung hoà | Bari cacbonat |
| 29 | Ca(OH)2 | Bazơ tan | Canxi hiđroxit |
| 30 | ZnSO4 | Muối trung hoà | Kẽm sunfat |
| 31 | CaSO4 | Muối trung hoà | Canxi photphat |
| 32 | Fe(NO3)2 | Muối trung hoà | Sắt (II) nitrat |
| 33 | Ca(NO3)2 | Muối trung hoà | Canxi nitrat |
| 34 | Fe(OH)2 | Bazơ không tan | Sắt (I) hiđroxit |
| 35 | K3PO4 | Muối trung hoà | Kali photphat |
| 36 | Ba3(PO4)2 | Muối trung hoà | Bari photphat |
| 37 | AgNO3 | Muối trung hoà | Bạc nitrat |
| 38 | AgCl | Muối trung hoà | Bạc clorua |
| 39 | K2SO3 | Muối trung hoà | Kali sunfit |
| 40 | SO2 | Oxit axit | Lưu huỳnh đioxit |
| 41 | CaCO3 | Muối trung hoà | Canxi cacobnat |
| 42 | CaCl2 | Muối trung hoà | Canxi clorua |
| 43 | CO2 | Oxit axit | Cacbon đioxit |
| 44 | Ba(NO3)2 | Muối trung hoà | Bari nitrat |
| 45 | MgSO3 | Muối trung hoà | Magie sunfit |
| 46 | MgSO4 | Muối trung hoà | Magie sunfat |
| 47 | MgCO3 | Muối trung hoà | Magie cacobnat |
| 48 | Mg(NO3)2 | Muối trung hoà | Magie nitrat |
| 49 | FeSO3 | Muối trung hoà | Sắt (II) sunfit |
| 50 | K2CO3 | Muối trung hoà | Kali cacbonat |
| 51 | CaSO3 | Muối trung hoà | Canxi sunfit |
| 52 | Ca3(PO4)2 | Muối trung hoà | Canxit photphat |
| 53 | NaNO3 | Muối trung hoà | Natri nitrat |
| 54 | FeSO4 | Muối trung hoà | Sắt (II) sunfat |
19. \(BaO+SO_3\rightarrow BaSO_4\)
20. \(3K_2O+P_2O_5\rightarrow2K_3PO_4\)
21. \(3CaO+P_2O_5\rightarrow Ca_3\left(PO_4\right)_2\)
22. \(K_2O+N_2O_5\rightarrow2KNO_3\)
23. \(BaO+N_2O_5\rightarrow Ba\left(NO_3\right)_2\)
24. \(Na_2O+2HCl\rightarrow2NaCl+H_2O\)
25. \(CaO+2HCl\rightarrow CaCl_2+H_2O\)
26. \(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
27. \(K_2O+H_2SO_4\rightarrow K_2SO_4+H_2O\)
28. \(BaO+H_2SO_4\rightarrow BaSO_4\downarrow+H_2O\)
29. \(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
30. \(K_2O+2HNO_3\rightarrow2KNO_3+H_2O\)
31. \(ZnO+2HNO_3\rightarrow Zn\left(NO_3\right)_2+H_2O\)
32. \(Fe_2O_3+6HNO_3\rightarrow2Fe\left(NO_3\right)_3+3H_2O\)
33. \(3Na_2O+2H_3PO_4\rightarrow2Na_3PO_4\)
34. \(3MgO+2H_3PO_4\rightarrow Mg_3\left(PO_4\right)_2\downarrow+3H_2O\)
35. \(Al_2O_3+2H_3PO_4\rightarrow2AlPO_4\downarrow+3H_2O\)
36. \(Fe_3O_4+8HCl\rightarrow FeCl_2+2FeCl_3+4H_2O\)
37. \(Fe_3O_4+4H_2SO_4\rightarrow FeSO_4+Fe_2\left(SO_4\right)_3+4H_2O\)
38. \(3Fe_3O_4+8H_3PO_4\rightarrow Fe_3\left(PO_4\right)_2\downarrow+6FePO_4\downarrow+12H_2O\)
39. \(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
40. \(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\)
41. \(SO_2+2KOH\rightarrow K_2SO_3+H_2O\)
42. \(SO_2+Ba\left(OH\right)_2\rightarrow BaSO_3\downarrow+H_2O\)
43. \(SO_3+2NaOH\rightarrow Na_2SO_4+H_2O\)
44. \(SO_3+Ba\left(OH\right)_2\rightarrow BaSO_4\downarrow+H_2O\)
45. \(N_2O_5+2KOH\rightarrow2KNO_3+H_2O\)
46. \(N_2O_5+Ca\left(OH\right)_2\rightarrow Ca\left(NO_3\right)_2+H_2O\)
47. \(P_2O_5+6NaOH\rightarrow2Na_3PO_4+3H_2O\)
48. \(P_2O_5+3Ba\left(OH\right)_2\rightarrow Ba_3\left(PO_4\right)_2\downarrow+3H_2O\)
| STT | CTHH | Phân loại | Tên gọi |
| 55 | BaO | oxit bazơ | bari oxit |
| 56 | CaO | oxit bazơ | canxi oxit |
| 57 | N2O5 | oxit axit | đinitơ pentaoxit |
| 58 | Zn(NO3)2 | muối trung hoà | kẽm nitrat |
| 59 | Na2O | oxit bazơ | natri oxit |
| 60 | MgO | oxit bazơ | magie oxit |
| 61 | Al2O3 | oxit lưỡng tính | nhôm oxit |
| 62 | ZnO | oxit lưỡng tính | kẽm oxit |
| 63 | Fe3(PO4)2 | muối trung hoà | sắt (II) photphat |
| 64 | FePO4 | muối trung hoà | sắt (III) photphat |
a) \(4NH_3+5O_2\xrightarrow[Pt]{t^o}4NO\uparrow+6H_2O\)
b) \(4Mg+10HNO_3\rightarrow4Mg\left(NO_3\right)_2+NH_4NO_3+3H_2O\)
c) \(4Zn+5H_2SO_{4\left(đặc,nóng\right)}\rightarrow4ZnSO_4+H_2S\uparrow+4H_2O\)
d) \(MnO_2+4HCl\rightarrow MnCl_2+Cl_2\uparrow+2H_2O\)
e) \(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2\uparrow+8H_2O\)
f) \(2KMnO_4+10FeSO_4+8H_2SO_4\rightarrow K_2SO_4+MnSO_4+5Fe_2\left(SO_4\right)_3+8H_2O\)
g) \(2KMnO_4+3K_2SO_3+H_2O\rightarrow2KOH+2MnO_2\downarrow+3K_2SO_4\)
h) \(8FeO+26HNO_3\rightarrow8Fe\left(NO_3\right)_3+N_2O\uparrow+13H_2O\)
Câu 27:
Gọi \(\left\{{}\begin{matrix}n_{C_2H_2\left(dư\right)}=a\left(mol\right)\\n_{C_4H_4\left(dư\right)}=b\left(mol\right)\end{matrix}\right.\)
\(n_{Br_2}=0,05.1=0,05\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{C_2H_2\left(dư\right)}=a\left(mol\right)\\n_{C_4H_4\left(dư\right)}=b\left(mol\right)\end{matrix}\right.\)
=> \(n_{\pi\left(dư\right)}=2a+3b\left(mol\right)\)
\(\text{BTLK }\pi:2n_{C_2H_2}+3n_{C_4H_4}=n_{H_2}+n_{Br_2}+n_{\pi\left(dư\right)}\)
=> 2a + 3b = 2.0,06 + 3.0,09 - 0,16 - 0,05 = 0,18 (*)
\(n_{khí.Z}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
Theo ĐLBTKL:
\(m_Y=m_X=0,06.26+0,09.52+0,16.2=6,56\left(g\right)\)
Ta có: \(M_Y=\dfrac{328}{15}.2=\dfrac{656}{15}\left(g/mol\right)\)
=> \(n_Y=\dfrac{6,56}{\dfrac{656}{15}}=0,15\left(mol\right)\)
Lại có: \(n_{C_2H_2\left(dư\right)}+n_{C_4H_4\left(dư\right)}=n_Y-n_Z=0,15-0,08=0,07\left(mol\right)\)
=> a + b = 0,07 (**)
Từ (*), (**) => a = 0,03; b = 0,04
PTHH:
\(C_2H_2\xrightarrow[]{+AgNO_3/NH_3}C_2Ag_2\downarrow\)
0,03----------------->0,03
\(C_4H_4\xrightarrow[]{+AgNO_3/NH_3}C_4H_3Ag\downarrow\)
0,04------------------>0,04
=> m = 0,03.240 + 0,04.159 = 13,56 (g)
=> Chọn C
Câu 28:
\(n_{hh.khí}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
=> \(\left\{{}\begin{matrix}n_{C_2H_2}=\dfrac{2}{2+3}.0,1=0,04\left(mol\right)\\n_{H_2}=0,1-0,04=0,06\left(mol\right)\end{matrix}\right.\)
\(n_Z=\dfrac{0,896}{22,4}=0,04\left(mol\right)\)
Sơ đồ phản ứng:
\(X\left\{{}\begin{matrix}C_2H_2:0,04\text{ }mol\\H_2:0,06\text{ }mol\end{matrix}\right.\xrightarrow[t^o]{Ni}Y\left\{{}\begin{matrix}H_2\\C_2H_2\\C_2H_4\\C_2H_6\end{matrix}\right.\xrightarrow[]{+Br_2}0,04\text{ }mol\text{ }Z\left\{{}\begin{matrix}H_2\\C_2H_6\end{matrix}\right.\)
Ta có: \(M_Z=4,5.2=9\left(g/mol\right)\)
=> mZ = 9.0,04 = 0,36 (g)
Theo ĐLBTKL: mY = mX = 0,04.26 + 0,06.2 = 1,16 (g)
Ta có: \(m_{C_2H_2\left(pư\right)}+m_{C_2H_4\left(pư\right)}=m_Y-m_Z=1,16-0,36=0,8\left(g\right)\)
Mà \(m_{tăng}=m_{C_2H_2\left(pư\right)}+m_{C_2H_4\left(pư\right)}\) => mtăng = 0,8 (g)
=> Chọn B
Câu 29:
Ta có: MY = 14,5.2 = 29 (g/mol)
Theo ĐLBTKL: mY = mX = 0,45.2 + 0,15.52 = 8,7 (g)
=> \(n_Y=\dfrac{8,7}{29}=0,3\left(mol\right)\)
Ta có: ngiảm = mH2 (tham gia phản ứng cộng) => nH2 = 0,3 (mol)
Theo BTLK \(\pi:3n_{C_4H_4}=n_{H_2\left(pư\right)}+n_{Br_2}\)
=> \(n_{Br_2}=3.0,15-0,3=0,15\left(mol\right)\)
=> m = 0,15.160 = 24 (g)
=> Chọn D
MX = 6,7.2 = 13,4 (g)
MY = 16,75.2 = 33,5 (g)
Giả sử có 1 mol X => mX = 13,4.1 = 13,4 (g)
Gọi nH2 (phản ứng) = x (mol) => nY = nX - nH2 (phản ứng) = 1 - x (mol)
Theo ĐLBTKL: mY = mX = 13,4 (g)
=> \(M_Y=\dfrac{13,4}{1-x}=33,5\left(g/mol\right)\)
=> x = 0,6 (mol)
Nếu A là anken
BTLK \(\pi:n_A=n_{H_2}=0,6\left(mol\right)\)
=> nH2 (dư) = 1 - 0,6 - 0,6 = - 0,2 (mol) (vô lý)
=> Loại
Nếu A là ankin
BTLK \(\pi:2n_A=n_{H_2}\Rightarrow n_A=\dfrac{0,6}{2}=0,3\left(mol\right)\)
=> nH2 (dư) = 1 - 0,6 - 0,3 = 0,1 (mol)
=> \(\Sigma n_{H_2}=0,1+0,6=0,7\left(mol\right)\)
Áp dụng sơ đồ đường chéo đối với hỗn hợp khí X:
\(\dfrac{n_A}{n_{H_2}}=\dfrac{V_A}{V_{H_2}}=\dfrac{13,4-2}{M_A-13,4}\)
=> \(\dfrac{0,3}{0,7}=\dfrac{11,4}{M_A-13,4}\Rightarrow M_A=40\left(g/mol\right)\)
=> \(A:C_3H_4\)
=> Chọn B
a)
| \(Fe^0-3e\rightarrow Fe^{+3}\) | \(\times2\) |
| \(2Cl^0+2e\rightarrow2Cl^-\) | \(\times3\) |
\(2Fe+3Cl_2\xrightarrow[]{t^o}2FeCl_3\)
b)
| \(Fe^{+2}-1e\rightarrow Fe^{+3}\) | \(\times4\) |
| \(2O^0-4e\rightarrow2O^{-2}\) | \(\times1\) |
\(4Fe\left(OH\right)_2+O_2+2H_2O\rightarrow4Fe\left(OH\right)_3\)
c)
| \(2xFe^{2y/x}-\left(6x-4y\right)e\rightarrow2xFe^{+3}\) | \(\times1\) |
| \(S^{+6}+2e\rightarrow S^{+4}\) | \(\times\left(3x-2y\right)\) |
\(2Fe_xO_y+\left(6x-2y\right)H_2SO_4\rightarrow xFe_2\left(SO_4\right)_3+\left(3x-2y\right)SO_2+\left(6x-2y\right)H_2O\)
d)
| \(xFe^{2y/x}+\left(3x-2y\right)e\rightarrow xFe^{+3}\) | \(\times1\) |
| \(N^{+5}+1e\rightarrow N^{+4}\) | \(\times\left(3x-2y\right)\) |
\(Fe_xO_y+\left(6x-2y\right)HNO_3\rightarrow xFe\left(NO_3\right)_3+\left(3x-2y\right)NO_2+\left(3x-y\right)H_2O\)
e)
| \(xFe^{2y/x}+\left(3x-2y\right)e\rightarrow xFe^{+3}\) | \(\times8\) |
| \(2N^{+5}+8e\rightarrow2N^{+1}\) | \(\times\left(3x-2y\right)\) |
\(8Fe_xO_y+\left(30x-4y\right)HNO_3\rightarrow8xFe\left(NO_3\right)_3+\left(3x-2y\right)N_2O+\left(15x-2y\right)H_2O\)
@Bảo Quang
a) \(n_{H_2SO_4}=0,2.1=0,2\left(mol\right)\)
\(m_{BaCl_2}=200.20,8\%=41,6\left(g\right)\Rightarrow n_{BaCl_2}=\dfrac{41,6}{208}=0,2\left(mol\right)\)
PTHH: \(BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\)
ban đầu 0,2 0,2
phản ứng 0,2 0,2
sau phản ứng 0 0 0,2 0,4
=> mkết tủa = 0,2.233 = 46,6 (g)
b) mdd H2SO4 = 200.1,2 = 240 (g)
mdd sau phản ứng = 240 + 200 - 46,6 = 393,4 (g)
=> \(C\%_{HCl}=\dfrac{0,4.36,5}{393,4}.100\%=3,71\%\)
@Bảo Quang
Vì \(MNCK\) là hình bình hành
\(\Rightarrow MN//CK\)
Mà \(CK\perp BC\) (do ABCD là hình chữ nhật)
\(\Rightarrow MN\perp BC\)
Xét \(\Delta BMC\) có: \(\left\{{}\begin{matrix}BH\perp MC\left(gt\right)\\MN\perp BC\left(cmt\right)\\\text{BH cắt MN tại N}\end{matrix}\right.\)
\(\Rightarrow N\) là trực tâm của \(\Delta BMC\)
\(\Rightarrow CN\perp BM\)
Mà \(MK//NC\) (do \(MNCK\) là hình bình hành)
\(\Rightarrow MK\perp BM\)
\(\Rightarrow\widehat{BMK}=90^0\)
\(3^x=\dfrac{9^8}{27^3.81^2}\)
\(3^x=\dfrac{\left(3^2\right)^8}{\left(3^3\right)^3.\left(3^4\right)^2}\)
\(3^x=\dfrac{3^{16}}{3^9.3^8}\)
\(3^x=\dfrac{3^{16}}{3^{17}}\)
\(3^x=\dfrac{1}{3}\)
\(3^x=3^{-1}\)
\(\Rightarrow x=-1\)
Vậy x = -1
Đổi 3,4 tấn = 3400 kg
Gọi \(\left\{{}\begin{matrix}n_{N_2}=a\left(kmol\right)\\n_{H_2}=b\left(kmol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}a:b=1:3\\28a+2b=3400000\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}a=100\left(kmol\right)\\b=300\left(kmol\right)\end{matrix}\right.\)
Gọi \(n_{N_2\left(pư\right)}=x\left(kmol\right)\)
PTHH: \(N_2+3H_2\xrightarrow[200atm]{250^oC}2NH_3\)
x----->3x---------->2x
=> \(\left\{{}\begin{matrix}n_{N_2\left(dư\right)}=100-x\left(kmol\right)\\n_{H_2}=300-3x\left(kmol\right)\\n_{NH_3}=2x\left(kmol\right)\end{matrix}\right.\)
=> \(\dfrac{2x}{100-x+300-3x+2x}.100\%=25\%\)
=> x = 40 (kmol)
Xét \(\dfrac{n_{N_2}}{1}=\dfrac{n_{H_2}}{3}\left(\dfrac{1}{1}=\dfrac{3}{3}\right)\) => hiệu suất phản ứng có thể tính theo cả 2
=> \(H=\dfrac{40}{100}.100\%=40\%\)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\Rightarrow m_{H_2}=0,1.2=0,2\left(g\right)\)
PTHH:
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\) (1)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\) (2)
Theo PTHH (1), (2): \(n_{H_2SO_4}=n_{H_2}=0,1\left(mol\right)\)
=> \(m_{H_2SO_4}=0,1.98=9,8\left(g\right)\)
=> \(m_{ddH_2SO_4}=\dfrac{9,8.100}{20}=49\left(g\right)\)
mdd sau phản ứng = mhh kim loại + mdd H2SO4 - mH2 = 3,68 + 49 - 0,2 = 52,48 (g)
- Trích mẫu thử, đánh số thứ tự
- Cho lần lượt các mẫu thử tác dụng với các mẫu thử còn lại, ta được kết quả ở bảng sau:
| \(H_2SO_4\) | \(Na_2CO_3\) | \(BaCl_2\) | |
| \(H_2SO_4\) | \ | \(\uparrow\) không màu, không mùi | \(\downarrow\) trắng |
| \(Na_2CO_3\) | \(\uparrow\) không màu, không mùi | \ | \(\downarrow\) trắng |
| \(BaCl_2\) | \(\uparrow\) trắng | \(\uparrow\) trắng | \ |
- Từ bảng trên, ta có kết quả:
+ Mẫu thử tạo 2 kết tủa trắng: BaCl2
+ Mẫu thử tạo 1 kết tủa trắng, 1 khí không màu, không mùi: Na2CO3, H2SO4 (1)
\(Na_2CO_3+BaCl_2\rightarrow BaCO_3\downarrow+2NaCl\)
\(Na_2CO_3+H_2SO_4\rightarrow BaSO_4\downarrow+CO_2+H_2O\)
\(H_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2HCl\)
- Cho kết tủa của từng mẫu thử (1) tác dụng với mẫu thử còn lại:
+ Có sủi bọt khí không màu không mùi: BaCO3 -> Chất ban đầu là Na2CO3
\(BaCO_3+H_2SO_4\rightarrow BaSO_4\downarrow+CO_2\uparrow+H_2O\)
+ Kết tủa không tan trong dd: BaSO4 -> Chất ban đầu là H2SO4
- Dán nhãn
@Anguyen1127
\(n_{Fe_3O_4}=\dfrac{13,92}{232}=0,06\left(mol\right);n_{N_xO_y}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\)
Quá trình oxi hoá - khử:
\(3Fe^{+\dfrac{8}{3}}\rightarrow3Fe^{+3}+1e\)
\(xN^{+5}+\left(5x-2y\right)e\rightarrow xN^{+2y/x}\)
Bảo toàn electron: \(n_{Fe_3O_4}=\left(5x-2y\right)n_{N_xO_y}\)
=> \(0,06=\left(5x-2y\right).0,02\)
=> \(5x-2y=\dfrac{0,06}{0,02}=3\)
=> x = 1; y = 1
=> NxOy là NO
@Bảo Quang
Câu 7:
Gọi số liên kết pi trong hỗn hợp E là k
Quy đổi hỗn hợp thành: \(C_nH_{2n+2-2k}\)
PTHH: \(C_nH_{2n+2-2k}+\dfrac{\left(3n+1-k\right)}{2}O_2\xrightarrow[]{t^o}nCO_2+\left(n+1-k\right)H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_C=n_{CO_2}=\dfrac{8,064}{22,4}=0,36\left(mol\right)\\n_H=2n_{H_2O}=2.\dfrac{7,56}{18}=0,84\left(mol\right)\end{matrix}\right.\)
Theo PTHH: \(n_{CO_2}-n_{H_2O}=\left(k-1\right).n_E\)
=> \(\left(k-1\right).x=-0,06\) (1)
=> \(m_E=0,84+0,36.12=5,16\left(g\right)\)
6,192 gam E có: \(n_E=x.\dfrac{6,192}{5,16}=1,2x\left(mol\right)\)
Bảo toàn liên kết pi: \(k.n_E=n_{Br_2}\)
=> k.1,2x = 0,168 (2)
Từ (1), (2) => \(\left\{{}\begin{matrix}x=0,2\\k=0,7\end{matrix}\right.\)
Chọn C
Tương tự ta được
Câu 8: B
Câu 9: D
Câu 10:
Công thức tổng quát của X là \(C_nH_{2n+2-2k}\)
PTHH: \(C_nH_{2n+2-2k}+\dfrac{\left(3n+1-k\right)}{2}O_2\xrightarrow[]{t^o}nCO_2+\left(n+1-k\right)H_2O\)
0,12---------------------------------->0,12n----->0,12(n + 1 - k)
Ta có: \(m_{CO_2}+m_{H_2O}=23,9\)
=> 0,12n.44 + 18.0,12n(n + 1 - k) = 23,9 (1)
Mặt khác
PTHH: \(C_nH_{2n+2-2k}+kBr_2\rightarrow C_nH_{2n+2-2k}Br_{2k}\)
\(\dfrac{0,68}{k}\)<-------0,68
=> \(\overline{M_{C_nH_{2n+2-2k}}}=\dfrac{22}{\dfrac{0,68}{k}}=\dfrac{550k}{17}\left(g/mol\right)\)
=> \(12n+2n+2-2k=\dfrac{550k}{17}\) (2)
Từ (1), (2) => \(\left\{{}\begin{matrix}n=\dfrac{10}{3}\\k=\dfrac{17}{12}\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}n_{CO_2}=0,12.\dfrac{10}{3}=0,4\left(mol\right)\\n_{H_2O}=0,12.\left(0,4+1-\dfrac{17}{12}\right)=0,35\left(mol\right)\end{matrix}\right.\)
Bảo toàn nguyên tố O: \(n_{O_2}=n_{CO_2}+\dfrac{1}{2}n_{H_2O}=0,575\left(mol\right)\)
=> V = 0,575.22,4 = 12,88 (l) (Gần nhất với 13)
Chọn B
Vận dụng 1:
| HCl | Al2O3 | Ba(OH)2 | Na | SO3 | N2O | H3PO4 | CaO | KOH | Fe2O3 | |
| Ag | ||||||||||
| NaOH | x | x | x | x | ||||||
| H2SO4 | x | x | x | x | x | x | x | |||
| CO2 | x | x | x | |||||||
| Fe(OH)3 | x | x | ||||||||
| Ag2O | x | x | ||||||||
| ZnO | x | x | x | x |
Đặt: \(A=3^2+3^4+...+3^{50}\)
\(\Rightarrow3^2A=3^4+3^6+...+3^{52}\)
\(\Rightarrow9A-A=\left(3^4+3^6+...+3^{52}\right)-\left(3^2+3^4+...+3^{50}\right)\)
\(\Rightarrow8A=3^{52}-3^2\)
\(\Rightarrow A=\dfrac{3^{52}-3^2}{8}\)
Vậy \(3^2+3^4+...+3^{50}=\dfrac{3^{52}-3^2}{8}\)
Anguyen1127
HĐ247
| \(2xFe^{+\dfrac{2y}{x}}\rightarrow2xFe^{+3}+\left(6x-4y\right)e\) | \(\times1\) |
| \(S^{+6}+2e\rightarrow S^{+4}\) | \(\times\left(3x-2y\right)\) |
\(2Fe_xO_y+\left(6x-2y\right)H_2SO_4\rightarrow xFe_2\left(SO_4\right)_3+\left(3x-2y\right)SO_2\uparrow+\left(6x-2y\right)H_2O\)
| \(axFe^{+\dfrac{2y}{x}}+\left(2ay-2bx\right)e\rightarrow axFe^{+\dfrac{2b}{a}}\) | \(\times1\) |
| \(C^{+2}\rightarrow C^{+4}+2e\) | \(\times\left(ay-bx\right)\) |
\(aFe_xO_y+\left(ay-bx\right)CO\xrightarrow[]{t^o}xFe_aO_b+\left(ay-bx\right)CO_2\)
Anguyen1127
#HĐ247
\(\Rightarrow0< \dfrac{5,7}{36-M_M}< \dfrac{1}{3}\\ \Leftrightarrow\left\{{}\begin{matrix}\dfrac{5,7}{36-M_M}>0\\\dfrac{5,7}{36-M_M}< \dfrac{1}{3}\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}36-M_M>0\\36-M_M>\dfrac{5,7}{\dfrac{1}{3}}=17,1\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}M_M< 36\\M_M< 36-17,1=18,9\end{matrix}\right.\)
\(\Leftrightarrow18,9< M_M< 36\)
Kết hợp với M có hoá trị III
\(\Rightarrow M\) là nhôm (Al)
#HĐ247
@Anguyen1127
Ta thấy: lượng kết tủa tại thời điểm số mol NaOH lần lượt là 0,3 và 0,5 như nhau => Tại thời điểm 0,3 AlCl3 dư, tại thời điểm 0,5 NaOH dư
PTHH: \(NaOH+HCl\rightarrow NaCl+H_2O\) (1)
\(3NaOH+AlCl_3\rightarrow Al\left(OH\right)_3\downarrow+3NaCl\) (2)
\(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\) (3)
`-` Tại thời điểm nNaOH = 0,3
Theo (1): \(n_{NaOH\left(pư\right)}=n_{HCl}=x\left(mol\right)\)
`=>` \(n_{NaOH\left(dư\text{ }sau\text{ }\left(1\right)\right)}=0,3-x\left(mol\right)\)
Theo `(2):` \(n_{Al\left(OH\right)_3}=\dfrac{1}{3}n_{NaOH}=\dfrac{1}{3}.\left(0,3-x\right)\left(mol\right)\)
`-` Tại thời điểm nNaOH = 0,5
Theo `(1), (2):` \(n_{NaOH\left(pư\right)}=n_{HCl}+3n_{AlCl_3}=x+3y\left(mol\right)\)
`=>` nNaOH (dư sau (1), (2) ) = 0,5 - x - 3y (mol)
Theo (2): \(n_{Al\left(OH\right)_3}=n_{AlCl_3}=y\left(mol\right)\)
Theo (3): \(n_{Al\left(OH\right)_3\left(pư\right)}=n_{NaOH}=0,5-x-3y\left(mol\right)\)
`=>` \(n_{Al\left(OH\right)_3\left(dư\right)}=x+4y-0,5\left(mol\right)\)
Vì số khối lượng kết tủa tại 2 thời điểm như nhau
`=>` \(\dfrac{1}{3}.\left(0,3-x\right)=x+4y-0,5\) (*)
`-` Tại thời điểm nNaOH = 0,55, kết tủa bị hoà tan hết:
Theo (2): \(n_{Al\left(OH\right)_3}=n_{AlCl_3}=y\left(mol\right)\)
Theo (1), (2), (3): \(n_{NaOH}=n_{HCl}+3n_{AlCl_3}+n_{Al\left(OH\right)_3}\)
`=>` \(x+4y=0,55\) (**)
Từ (*), (**) `=>` \(\left\{{}\begin{matrix}x=0,15\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
HĐ247
@Anguyen1127
Tại thời điểm khối lượng 36,51 gam là lượng kết tủa lớn nhất gồm Al(OH)3, BaSO4. Còn tại thời điểm 34,95 gam là lượng kết tủa chỉ gồm có BaSO4.
PTHH: \(Na_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4\downarrow+2NaOH\)
\(Al_2\left(SO_4\right)_3+3Ba\left(OH\right)_2\rightarrow2Al\left(OH\right)_3\downarrow+3BaSO_4\downarrow\)
\(2Al\left(OH\right)_3+Ba\left(OH\right)_2\rightarrow Ba\left(AlO_2\right)_2+4H_2O\)
\(n_{BaSO_4}=\dfrac{34,95}{233}=0,15\left(mol\right)\\ n_{Al\left(OH\right)_3}=\dfrac{36,51-34,95}{78}=0,02\left(mol\right)\)
\(\xrightarrow[]{\text{BTNT Al}}\) \(b=n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al\left(OH\right)_3}=0,01\left(mol\right)\)
\(\xrightarrow[]{\text{BTNT =SO}_4}\) \(a=n_{Na_2SO_4}=n_{BaSO_4}-3n_{Al_2\left(SO_4\right)_3}=0,12\)
#HĐ247
@Anguyen1127
| Thành phần | CTHH | Phân loại | Tên gọi |
| `Al` và `OH` | `Al(OH)_3` | bazơ | nhôm hiđroxit |
| `H` và `PO_4` | `H_3PO_4` | axit | axit photphoric |
| `Ba` và `O` | `BaO` | oxit bazơ | bari oxit |
| `C (IV)` và `O` | `CO_2` | oxit axit | cacbon đioxit |
| `P (V)` và `O` | `P_2O_5` | oxit axit | điphotpho pentaoxit |
| `Al` và `SO_4` | `Al_2(SO_4)_3` | muối | nhôm sunfat |
| `Fe (II)` và `NO_3` | `Fe(NO_3)_2` | muối | sắt (II) nitrat |
| `Al` và `HSO_4` | `Al(HSO_4)_3` | muối | nhôm hiđrosunfat |
| `H` và `SO_3` | `H_2SO_3` | axit | axit sunfurơ |
| `Ca` và `HSO_3` | `Ca(HSO_3)_2` | muối | canxi hiđrosunfit |
| `Mg` và `H_2PO_4` | `Mg(H_2PO_4)_2` | muối | magie đihiđrophotphat |
| `H` và `Cl` | `HCl` | axit | axit clohiđric |
| `Na` và `CO_3` | `Na_2CO_3` | muối | natri cacbonat |
| `H` và `PO_4` | `H_3PO_4` | axit | axit photphoric |
| `Ca` và `HCO_3` | `Ca(HCO_3)_2` | muối | canxi hiđrocacbonat |
#HĐ247
@Anguyen1127
Bài 11:
1) Làm đổi màu chất chỉ thị màu. dd axit làm quỳ tím hoá đỏ
2) Tác dụng với oxit bazơ -> muối + nước
2HCl + CaO -> CaCl2 + H2O
H2SO4 + BaO -> BaSO4 + H2O
Fe2O3 + 6HNO3 -> 2Fe(NO3)3 + 3H2O
3) Tác dụng với bazơ -> muối + nước
Ba(OH)2 + H2SO4 -> BaSO4 + 2H2O
NaOH + HNO3 -> NaNO3 + H2O
Fe(OH)3 + 3HCl -> FeCl3 + 3H2O
4) Tác dụng với kim loại
2HCl + Zn -> ZnCl2 + H2
Mg + H2SO4 -> MgSO4 + H2
Ca + 2HBr -> CaBr2 + H2
Bài 12:
1) Mg + 2HCl -> MgCl2 + H2
Khí cháy được trong không khí ở đây là H2
\(2H_2+O_2\xrightarrow[]{t^o}2H_2O\)
2) MgCO3 + 2HCl -> MgCl2 + CO2 + H2O
Khí làm đục nước vôi trong là CO2
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
3) CuO + 2HCl -> CuCl2 + H2O
dd có màu xanh là CuCl2
4) MgO + 2HCl -> MgCl2 + H2O
MgCl2 là dd không màu
Bài 13:
Gọi hoá trị của kim loại A là n (n ∈ N*)
PTHH: 2A + 2nHCl -> 2ACln + nH2
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PTHH: \(n_A=\dfrac{2}{n}.n_{H_2}=\dfrac{2}{n}.0,1=\dfrac{0,2}{n}\left(mol\right)\)
=> \(M_A=\dfrac{6,5}{\dfrac{0,2}{n}}=32,5n\left(g/mol\right)\)
Vì n là hoá trị của A nên ta có bảng giá trị
| n | 1 | 2 | 3 |
| MA | 32,5 | 65 | 97,6 |
| (Loại) | (Zn) | (Loại) |
Vậy A là kim loại kẽm (Zn)
\(CaSiO_3:20+14+8.3=58\\ H_3PO_4:3+15+8.4=50\\ Al_2\left(SO_4\right)_3:13.2+\left(16+8.4\right).3=170\\ KMnO_4:19+25+8.4=76\\ Na_2S:11.2+16=38\\ BaCl_2:56+17.2=90\)
@Anguyen1127
#HĐ247
a) \(\left\{{}\begin{matrix}n_{Ba}=\dfrac{27,4}{137}=0,2\left(mol\right)\\n_{CuSO_4}=\dfrac{400.3,2\%}{160}=0,08\left(mol\right)\end{matrix}\right.\)
PTHH: \(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\)
0,2------------->0,2-------->0,2
\(Ba\left(OH\right)_2+CuSO_4\rightarrow BaSO_4\downarrow+Cu\left(OH\right)_2\downarrow\)
bđ 0,2 0,08
pư 0,08<--------0,08
spư 0,12 0 0,08 0,08
\(Cu\left(OH\right)_2\xrightarrow[]{t^o}CuO+H_2O\)
0,08--------->0,08
=> VH2 = 0,2.22,4 = 4,48 (l)
b) mchất rắn = mCuO + mBaSO4 = 0,08.80 + 0,08.233 = 25,04 (g)
c) \(m_{dd.sau.pư}=400+27,4-0,2.2-0,08.98-0,08.233=400,52\left(g\right)\)
=> \(C\%_{Ba\left(OH\right)_2\left(dư\right)}=\dfrac{0,12.171}{400,52}.100\%=5,12\%\)
@Anguyen1127
#HĐ247
a) Văn bản "Chiếu dời đo" của Lý Công Uẩn
b) Thắng địa trong "Chiếu dời đô" là: Nơi mà đất nước có thể ổn định lâu dài và ngày càng thêm phát triển. Nơi có vị trí địa lý, thế đất thuận lời và đẹp, nhân dân có thể yên tâm, sống thật thoải mái, là nơi hội tụ tinh hoa của đất trời.
c) Thành phần biệt lập: "được cái"
d) Phép liên kết nối tiếp
@Bảo Quang