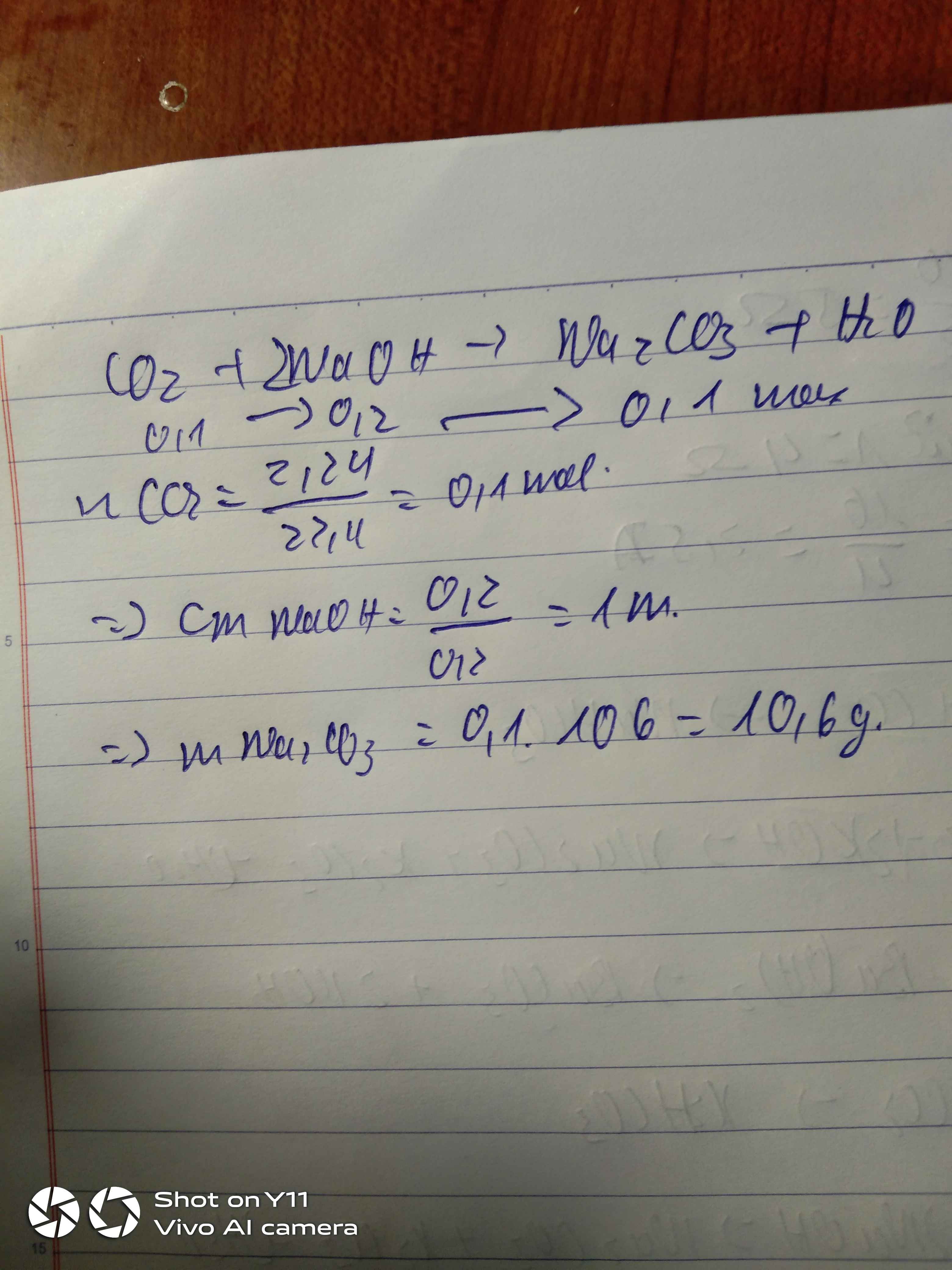Dẫn toàn bộ 2,24 lít khí cacbon đioxit ( CO 2 ) đo ở ( đktc) vào 200ml dung
dịch NaOH. Biết sau phản ứng xảy ra hoàn toàn ta thu được muối trung hòa.
a. Viết phương trình phản ứng xảy ra.
b. Tính nồng độ mol của dung dịch NaOH tham gia phản ứng.
c. Tính khối lượng muối trung hòa tạo thành.
( C = 12, O =16, Na = 23, H = 1)
\(a/ CO_2+2NaOH \to Na_2CO_3+H_2O\\ n_{CO_2}=0,1(mol)\\ b/\\ n_{NaOH}=0,1.2=0,2(mol)\\ CM_{NaOH}=\frac{0,2}{0,2}=1M\\ c/\\ n_{Na_2CO_3}=n_{CO_2}=0,1(mol)\\ m_{Na_2CO_3}=0,1.106==10,6(g)$\)
\(n_{CO2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
a) Pt : \(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O|\)
1 2 1 1
0,1 0,2 0,1
b) \(n_{NaOH}=\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
200ml = 0,2l
\(C_{M_{ddNaOH}}=\dfrac{0,2}{0,2}=1\left(M\right)\)
c) \(n_{Na2CO3}=\dfrac{0,2.1}{2}=0,1\left(mol\right)\)
⇒ \(m_{Na2CO3}=0,1.106=10,6\left(g\right)\)
Chúc bạn học tốt