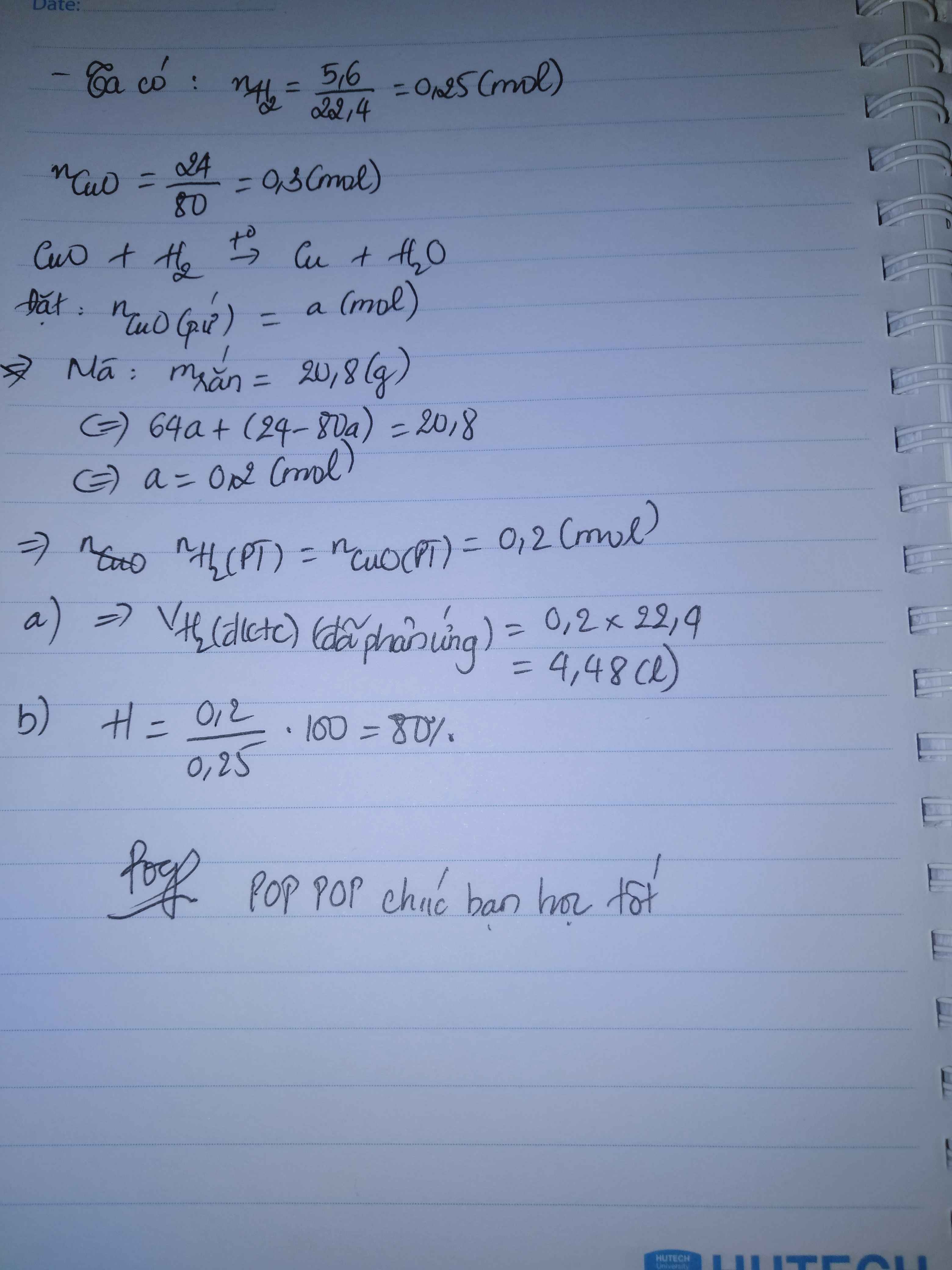a)
\(n_{CuO}=\dfrac{24}{80}=0,3\left(mol\right)\)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
Xét tỉ lệ \(\dfrac{0,3}{1}>\dfrac{0,25}{1}\)=> Hiệu suất tính theo H2
Gọi số mol CuO phản ứng là a
=> nCu = a (mol)
Có: (0,3-a).80 + 64a = 20,8
=> a = 0,2 (mol)
\(n_{H_2}=n_{CuO}=0,2\left(mol\right)\)
=> \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b) \(H\%=\dfrac{0,2}{0,25}.100\%=80\%\)
Số mol CuO bài ra là:
\(n_{CuObr}=\dfrac{24}{80}=0,3\left(mol\right)\)
Số mol hidro bài ra là:
\(n_{H_2br}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH
\(CuO+H_2\rightarrow Cu+H_2O\)
\(\dfrac{n_{CuObr}}{n_{CuOpt}}>\dfrac{n_{H_2br}}{n_{H_2pt}}\)
=> CuO dư sau phản ứng, bài toán tính theo hidro
Vậy thể tích hidro đã p/ứ là 5,6(lít)
b, Theo pt: \(n_{H_2}=n_{Cu}=0,25\left(mol\right)\)
Khối lượng Cu sản phẩm là:
\(m_{Cu}=0,25.64=16\left(g\right)\)
Hiệu suất của phản ứng là:
\(H=\dfrac{m_{Cu}}{m_{chat.ran}}.100\%=\dfrac{16}{20,8}.100\%\approx76,92\%\)