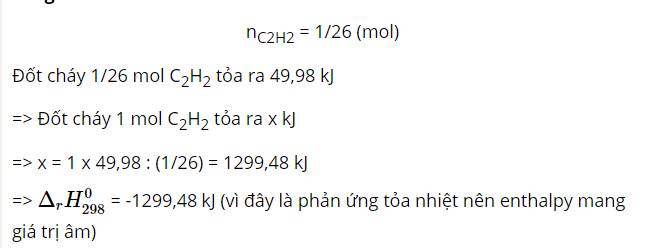Các câu hỏi tương tự
Đốt cháy hoàn toàn 1,00 gam khí C2H2 thu được CO2(k) và H2O(l) giải phóng 50,01 kJ. Tính biến thiên enthalpy của phản ứng đốt cháy 1 mol khí C2H2, từ đó cho biết vì sao C2H2 được sử dụng trong đèn xì hàn cắt kim loại mà không dùng mêtan.
d) Xác định biến thiên enthalpy chuẩn của phản ứng đốt cháy 1 mol ethane. Biết nhiệt tạo thành
chuẩn của C2H6 (l), CO2 (g) và H2O (l) tương ứng là -84,7 kJ/mol, -393,5 kJ/mol và -285,8
kJ/mol.
Methane là thành phần chính của khí thiên nhiên. Xét phản ứng đốt cháy methane:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ΔrH298
o = -890,3 kJ
Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là –393,5 và –285,8 kJ/mol. Hãy tính
nhiệt tạo thành chuẩn của khí methane.
a) Xác định biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
4FeS2 (s) + 11O2 (g) → 2Fe2O3 (s) + 8SO2 (g)
Biết nhiệt tạo thành ΔrH0298 của các chất FeS2(s), Fe2O3(s) và SO2(g) lần lượt là -177,9 kJ/mol,
-825,5 kJ/mol và -296,8 kJ/mol.
Đốt cháy hoàn toàn một hiđrocacbon thu được số mol CO2 bằng số mol H2O. Hiđrocacbon là
A. CH4 B. C2H4 C. C2H2 D. C6H6
Đọc tiếp
Đốt cháy hoàn toàn một hiđrocacbon thu được số mol CO2 bằng số mol H2O. Hiđrocacbon là
A. CH4 B. C2H4 C. C2H2 D. C6H6
Cho hỗn hợp B gồm C2H4 và C2H2.Lấy 2,96g hỗn hợp B đem đốt cháy hoàn toàn thu đc m1 gam CO2 và m2 gam H2O .Lấy 1,232 lít B (đktc) cho phản ứng với luongj dư nước brom thấy có 13,6g brom tham gia phản ứng(phản ứng xảy ra hoàn toàn)
a)Vt các phương trình phản ứng xảy ra
b)tính m1 và m2
a) Tính biến thiên enthalpy chuẩn của phản ứng: H2 (g) + Cl2 (g) → 2HCl (g)
Biết Eb (H – H) = 436 kJ/mol, Eb (Cl – Cl) = 243 kJ/mol, Eb (H – Cl) = 432 kJ/mol
b) Cho nhiệt tạo thành chuẩn của các chất tương ứng trong phương trình.
Chất N2O4 (g) CO (g) N2O (g) CO2 (g)
ΔrH0
298 (kJ/mol) 9,16 -110,50 82,05 -393,50
Tính biến thiên enthalpy chuẩn của phản ứng sau: N2O (g) + 3CO(g) ® N2O(g) + 3CO2(g)
Câu 30: Xét quá trình đốt cháy khí propane C3H8(g):
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
a) Tính biến thiên enthalpy chuẩn của phản ứng dựa vào bảng nhiệt tạo thành của hợp chất và dựa vào dựa vào bảng năng lượng liên kết.
Biết nhiệt tạo thành của C3H8(g); CO2(g) và H2O(g) lần lượt là : 105,00; 393,50 và 241,82 kJ/mol.
Biết EC-H 418 kJ/mol; EC-C 346 kJ/mol; EOO 494 kJ/mol; ECO 732 kJ/mol và EO-H 459 kJ/mol.
b) So sánh hai giá trị đó và nếu có sự khác biệt, hãy giải thích tại sao lại...
Đọc tiếp
Câu 30: Xét quá trình đốt cháy khí propane C3H8(g):
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
a) Tính biến thiên enthalpy chuẩn của phản ứng dựa vào bảng nhiệt tạo thành của hợp chất và dựa vào dựa vào bảng năng lượng liên kết.
Biết nhiệt tạo thành của C3H8(g); CO2(g) và H2O(g) lần lượt là : 105,00; 393,50 và 241,82 kJ/mol.
Biết EC-H = 418 kJ/mol; EC-C = 346 kJ/mol; EO=O = 494 kJ/mol; EC=O = 732 kJ/mol và EO-H = 459 kJ/mol.
b) So sánh hai giá trị đó và nếu có sự khác biệt, hãy giải thích tại sao lại có sự khác biệt đó ?